Эндотелиальная дисфункция и сердечная недостаточность
Введение
Если вы в последнее время читали о сердечно-сосудистых заболеваниях или недавно разговаривали с врачом о профилактике или лечении сердечно-сосудистых заболеваний, возможно, вы встречали термин «эндотелиальная дисфункция». Концепция эндотелиальной дисфункции стала важной в последние годы для нашего понимания многих сердечно-сосудистых заболеваний, включая ишемическую болезнь сердца (ИБС), артериальную гипертензию, микрососудистую стенокардию (кардиальный синдром Х), диастолическую дисфункцию и другие.
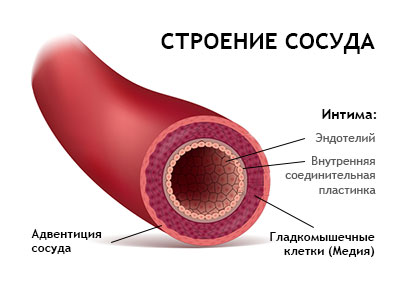
Эндотелиальная дисфункция — это состояние, при котором эндотелиальный слой (внутренняя оболочка) малых артерий не может нормально выполнять все свои важные функции. В результате с тканями, которые снабжаются этими артериями, может случиться несколько неприятных процессов.
Функция эндотелиального слоя
В артериолах организма (небольших артериях, которые точно регулируют поток крови к тканям) эндотелиальный слой (или эндотелий) является внутренней оболочкой клеток, которая выполняет несколько критических функций.

Эндотелий поддерживает правильное расширение и сужение кровеносных сосудов. Эта функция мгновенно определяет, сколько крови поступает в различные ткани организма. Эндотелиальный «тонус» (баланс между дилатацией и сужением) также в значительной степени определяет кровяное давление человека и то, сколько работы сердце должно проделать, чтобы выкачать кровь в организм.
Кроме того, эндотелий также защищает ткани от различных токсических веществ; регулирует механизм свертывания крови; контролирует жидкость, электролиты и многочисленные другие вещества, которые проходят между кровью и тканями; и регулирует воспаление в тканях.
Все это означает, что правильное функционирование эндотелия имеет решающее значение для нормального функционирования тканей и органов организма.
Когда эндотелиальный слой не выполняет все эти функции адекватно — иными словами, при наличии эндотелиальной дисфункции — условие будет благоприятствовать развитию атеросклероза, гипертонии (артериальной гипертензии) и другим сердечно-сосудистым заболеваниям.
Причины эндотелиальной дисфункции
Поскольку эндотелий так важен для многих жизненно важных функций, проводится много исследований, чтобы понять все причины эндотелиальной дисфункции. В этот момент очевидно, что эндотелиальная дисфункция связана со снижением уровня оксида азота (NO) в стенках кровеносных сосудов.
Оксиды азота представляют собой газ, который образуется в результате метаболизма аминокислоты (L-аргинин). Оксиды азота, имеющие очень короткий период полураспада, действуют локально в кровеносных сосудах, помогая модулировать тонус сосудов и другие важные эндотелиальные функции.
Дефицит продукции NO приводит к избыточному сужению кровеносных сосудов (которое может вызвать артериальную гипертензию), способствует активации тромбоцитов (приводит к свертыванию крови), увеличивает стимуляцию воспаления в стенках кровеносных сосудов (что способствует атеросклерозу) и увеличивает проницаемость стенок сосудов для повреждения липопротеинов и различных токсинов.
Подводя итог, можно сказать, что эндотелиальная дисфункция характеризуется снижением уровня оксида азота (NO) в сосудах, что, в свою очередь, приводит к нескольким нарушениям функции кровеносных сосудов. Эти функциональные нарушения способствуют развитию сердечно-сосудистых патологий.
Кроме того, эндотелиальная дисфункция может непосредственно вызывать аномальное сужение мелких артерий, и считается, что она является основным фактором, вызывающим кардиальный синдром Х и, возможно, диастолическую дисфункцию.
Нарушения и расстройства, сопутствующие эндотелиальной дисфункции

Точные причины, по которым у человека развивается эндотелиальная дисфункция, все еще изучаются. Тем не менее, очевидно, что этому способствуют многочисленные медицинские расстройства, привычки и неизбежные жизненные события, в том числе:
- повышенное кровяное давление (артериальная гипертензия);
- сахарный диабет;
- повышенные уровни холестерина и триглицеридов ЛПНП;
- курение;
- сидячий образ жизни;
- эмоциональный стресс (считается, что стрессовая кардиомиопатия, также известная как «синдром разбитого сердца» или кардиомиопатия Такоцубо, возникает в результате острой и тяжелой формы эндотелиальной дисфункции);
- инфекционные заболевания;
- сердечная недостаточность;
- гипотиреоз;
- остеопороз;
- естественное старение;
- химиотерапия и лучевая терапия;
- генетические влияния.
Диагностика
Делать формальный диагноз эндотелиальной дисфункции обычно нет необходимости. Некоторая степень дисфункции эндотелия может быть с уверенностью диагностирована у всех, кто имеет ишемическую болезнь сердца, гипертонию или основные факторы риска сердечно-сосудистых заболеваний (особенно перечисленные выше).
Таким образом, обследование эндотелиальной функции пациента — это не то, чем обычно занимаются врачи. Но если эндотелиальная дисфункция заподозрена у человека без четких причин (например, у человека, предположительно, имеющего кардиальный синдром X), диагноз может быть подтвержден различными диагностическими тестами, которые измеряют способность кровеносных сосудов расширяться (во время катетеризации или с помощью ультразвукового исследования) в ответ на введение ацетилхолина.
Лечение эндотелиальной дисфункции
Функционирование эндотелия может быть улучшено с помощью мер, направленных на снижение риска сердечно-сосудистых заболеваний, включая потерю веса, физические упражнения, прекращение курения, контроль гипертонии и диабета, которые всем нам обычно настоятельно рекомендуются.
Некоторые из этих мер контроля рисков были хорошо зарекомендованы для снижения эндотелиальной дисфункции. К ним относятся:
- применение статинов (фармацевтические препараты, направленные на борьбу с высокими уровнями холестерина в крови человека);
- средиземноморская диета;
- другие пищевые продукты, включая орехи, оливковое масло, темный шоколад, зеленый чай, растительные продукты;
- аэробные упражнения;
- потеря лишнего веса;
- применение ингибиторов АПФ (группа природных и синтетических химических соединений, применяющихся для терапии и профилактики сердечной и почечной недостаточности, для снижения артериального давления).
Кроме того, в настоящее время изучается несколько лекарственных препаратов, специально предназначенных для клинического улучшения эндотелиальной дисфункции. К перспективным агентам относятся нифедипин, эстроген, рунолазин, аспирин, L-аргенин и сильденафил.
Заключение
В последние годы медицинские исследования установили, что эндотелиальная дисфункция является важным фактором, способствующим возникновению многих видов сердечно-сосудистых расстройств. В то время как ведутся активные исследования по поиску путей улучшения лечения эндотелиальной функции и, следовательно, снижения риска сердечно-сосудистых заболеваний, мы уже многое можем сделать сами для решения этой проблемы. В частности, следует уделять большое внимание физическим упражнениям, бросать курить и при наличии таких заболеваний, как гипертония или диабет, работать с докторами.
Источник
Комментарии
Опубликовано в журнале:
“Российский кардиологический журнал”
»» N 2 2002
КЛИНИКА И ФАРМАЦИЯ Усманов Р.И., Нуритдинова Н.Б., Зуева Е.Б.
Ташкентский государственный медицинский институт, кафедра терапии, лечебного факультет
Резюме
Целью исследования явилось изучение влияния небиволола на состояние эндотелия артерий и показатели ремоделирования левого желудочка у больных с застойной сердечной недостаточностью. Группу наблюдения составили 46 больных II ФК (NYHA) в возрасте от 38 до 62 лет. Небиволол назначался в дозе 1,25 мг/сут с увеличением дозы до 2,5-5 мг/сут при хорошей переносимости. Срок наблюдения – 12 месяцев. Небиволол вызывал дозазависимое увеличение кровотока в сосудах плеча, что, вероятно, связано с активацией связи L-аргинин/NО эндотелиального происхождения. Активация эндотелиальной NO синтазы, возможно, объясняет положительное действие небиволола – в частности, на сердечный выброс, и, в целом, на процессы ремоделирования и показатели миокардиального стресса у больных СН. Небиволол может достаточно эффективно использоваться для “миокардиальной” разгрузки при СН. Терапия неоивололом способствует восстановлению эндотелий-зависимой регуляции периферического кровообращения с прямым сосудорасширяющим действием, связанным с активацией NO эндотелиального происхождения.
Ключевые слова: сердечная недостаточность, эхокардиография, ремоделирование, эндотелий, небиволол.
Современные принципы терапии сердечной недостаточности (СН) требуют новых подходов, воздействующих на процессы ремоделирования сердечно-сосудистой системы, и обязательной комбинации лекарственных средств с различной фармакодинамикой, учитывая сложный и многокомплексный генез заболевания [1, 2].
Увеличение периферической резистентности при СН может только частично объясняться активацией катехоламинэргической и ренин-ангиотепзиновой прессорной систем [3]. Снижение адаптации к нагрузке – это периферический патофизиологический феномен, в котором ключевую роль играет оксид азота (NO) [4]. Застойная сердечная недостаточность характеризуется снижением насосной функции сердца с различными эффектами на приток и отток из пораженного левого желудочка. Уменьшение сердечного выброса – причина снижения АД, с тенденцией к сокращению внутреннего радиуса сосудов, так как замыкается кривая давление/объем. Однако, вопреки возможному снижению кровотока, уменьшению размера сосудов, сохраняется тенденция в поддержании константы давления растяжения и в этом главенствующая роль принадлежит эндотелию, секретирующему NO [5].
Эндотелий является источником большого количества биологически активных веществ, которые играют важную роль в регуляции сосудистого тонуса и сердечной деятельности [5, 6]. Наиболее важным из них является NO – свободный радикал, образующийся в эндотелии из L-аргинина под действием кальций/кальмодулин-зависимой изоформы фермента NO-синтазы [7]. Активируя гуанилат-циклазу, NO увеличивает образование ц-ГМФ в гладкомышечных клетках, тромбоцитах, что обуславливает расслабление сосудов, ингибирует пролиферацию гладкомышечных клеток и тормозит активность тромбоцитов и макрофагов. Снижение синтеза NO эндотелиальными клетками сосудов является одним из патофизиологических базисов развития СН [5].
Полагают, что прогрессирование СН может быть результатом резкого снижения выработки NO, причем дефицит NO прямо пропорционален степени тяжести СН (чем выше функциональный класс, тем выраженное эндотелиальная дисфункция. связанная с дефицитом оксида азота) [6].
В настоящее время огромное значение придают верификации аномального эидотелиального ответа на различные стимулы с фармакологической коррекцией выявленных нарушений. Небиволол (Небилет, фирмы “Berlin-Chemie AG/Menarini Group”) – новый, “нетипичный” бета1-адреноблокатор, обладает двумя ключевыми качествами: он способен влиять на уровень ремоделирования левого желудочка и стимулировать синтез NO, корректора “ремоделирования” артериальной стенки [7].
В связи с изложенным, целью настоящего исследования явилось изучение гемодинамических эффектов небиволола у больных СН.
Материалы и методы
Изучение эффективности небиволола проводилось в рамках продольного проспективного исследования с самоконтролем. Группу наблюдения составили 46 больных с ЗСН II ФК по классификации Нью-Иоркской ассоциации кардиологов (NYHA) в возрасте от 38 до 62 лет. У 20 больных этиологическим фактором СН была артериальная гипертензия, у 16 – ИБС, у 10 – ДКМП. В качестве базовой терапии все больные получали фуросемид и капотен, что диктовалось избыточным накоплением Na и выраженной нейро-гормональной активацией. После гемодинамического обследования всем больным назначался небиволол в дозе 1,25 мг/сут с увеличением дозы с недельным интервалом до 2,5 и/или 5 мг/сут при хорошей переносимости.
Контрольную группу составили 17 практически здоровых добровольцев в возрасте от 44 до 58 лет. Группа сравнения включала 27 больных СН II ФК, этиологическим фактором которой были артериальная гипертензия и ИБС. Эта группа получала кардиоселективный бета-блокатор атенолол в дозе 50 мг 2 раза в сутки.
Деление больных на группы осуществлялось методом “последовательного пополнения групп”. Репрезентативность групп обеспечивалось методом “автоконтроля”, равномерным распределением больных по возрасту, полу, давности заболевания.
Суточное мониторирование артериального давления и ЭКГ проводили на аппарате Meditech Cardio Tens с использованием программы Medibase (Венгрия). Эхокардиографическое исследование проводили с помощью ультразвукового аппарата Acuson 128 ХР/10 (США) по методике [8]. Для оценки периферического кровообращения проводили допплерографию плечевой артерии на аппарате Kranzbuhler Logidor 4 (ФРГ). Исследование проводили до назаначения препарата, через 3, 6 и 12 мес наблюдения.
Результаты исследования
Через 1 месяц наблюдения статистически достоверные изменения касались лишь показателей АД и ЧСС: через 12 недель общее снижение систолического давления составило 17,1 % и диастолического – 15,3%. Небиволол урежал ЧСС в среднем на 14,6 удара/мин. Весь дальнейший период наблюдения эти показатели сохранялись приблизительно на одинаковом уровне.
Изменения КСО, КДО и ФВ имели тенденцию к улучшению, наиболее выраженную к 12 месяцу лечения. Так, КСО снизился на 22,4%, КДО – на 13,5% и ФВ увеличилась на 33,8% (рис. 1).
Рис. 1. Динамика КСО, КДО, ФВ левого желудочка в процессе терапии небивололом
При применении небиволола наблюдалось положительное влияние на параметры ремоделирования левого желудочка (ЛЖ). Индексы диастолической и систолической сферичности ЛЖ снижались на 9,6 и 12,2%, соответственно, что свидетельствует об уменьшении степени эксцентрической гипертрофии. Наблюдалсь также тенденция к восстановлению нормального соотношения между циркулярным и меридиальным стрессом левого желудочка: исходно КСМС1/КСМС2 и КДМС1/КДМС2 были снижены на 15,02% и 10,8%. В результате терапии небивололом эти показатели увеличились на 6,6% и 8,3% (рис. 2). Благодаря этому важнейшему эффекту терапии разрывался порочный круг, при котором высокий миокардиальный стресс способствовал прогрессированию процесса дезадаптивного ремоделирования ЛЖ, который в свою очередь, приводил к дальнейшему возрастанию миокардиального стресса. Масса миокарда снижалась без значительного изменения толщины стенок ЛЖ, индекс миокарда ЛЖ снижался на 5,7%, индекс относительной толщины миокардиальной стенки h/r увеличивался на 3,8%.
Pиc. 2. Влияние небиволола на показатели миокардиального стресса
Анализ данных допплерографии показал, что у всех больных с СН кровоток в плевой артерии был исходно снижен, составляя Vmax 0,34+/-0,11 и V 0,30+/-0,08 м/с, в контрольной группе – соответственно, 0,74+/-0,16 и 0,57+/-0,11 м/с. Индекс Пурсела в контрольной группе был 0,65+/-0,12, в группе наблюдения – 0,96+/-0,11 (табл. 1). Через 12 месяцев наблюдения величина максимального и среднего кровотока в плечевой артерии составила 0,62+/-0,08 м/с и 0,56+/-0,10 м/с, соответственно (р<0,05). Индекс сосудистой резистентности снизился в 1,4 раза (р<0,05) при снижении общего периферического сопротивления сосудов на 21,7%.
Обращает на себя внимание зависимость кровотока в плечевой артерии от дозы небиволола: при дозе 2,5 мг максимальный кровоток увеличился на 78,1%, при дозе 5 мг – на 85,7%; средний кровоток, соответственно, увеличился на 79,3% и 87,1%. Индекс Пурсела снизился на 25,8% и 30,5% при дозе небиволола 2,5 и 5 мг/сут (табл. 1).
Таблица 1. Показатели кровотока в плечевой артерии на фоне терапии небивололом
| Показатель | до лечения | через 6 месяцев | через 12 месяцев |
| В целом по группе (46 больных) | |||
| Vmax, м/с | 0,34+/-0,08 | 0,57+/-0,09 | 0,62+/-0,08* |
| V, м/с | 0,30+/-0,08 | 0,44+/-0,11 | 0,56+/-0,10* |
| Ri | 0,96+/-0,11 | 0,79+/-0,09 | 0,70+/-0,09* |
| Доза небиволола 2,5 мг/сут (22 больных) | |||
| Vmax, м/с | 0,32+/-0,09 | 0,54+/-0,08 | 0,57+/-0,08* |
| V, м/с | 0,29+/-0,09 | 0,42+/-0,10 | 0,52+/-0,08* |
| Ri | 0,97+/-0,09 | 0,83+/-0,09 | 0,72+/-0,08* |
| Доза небиволола 5 мг/сут (24 больных) | |||
| Vmax, м/с | 0,35+/-0,10 | 0,61+/-0,11 | 0,65+/-0,09* |
| V, м/с | 0,31+/-0,11 | 0,47+/-0,09 | 0,58+/-0,08* |
| Ri | 0,95+/-0,11 | 0,76+/-0,10 | 0,66+/-0,09* |
Примечание: * – р<0,05 – достоверность показателей по сравнению с исходом
После 4 недель терапии атенололом был продемонстрирован сопоставимый (с небивололом) гемодинамический эффект препарата на САД и ЧСС, которые снизились на 16,3% и 22,7%, соответственно. Однако, при применении Атенолола не наблюдалось практически никаких изменений кровотока в плечевой артерии (рис. 3). Некоторые изменения коснулись лишь индекса сосудистой резистентности: через 6 месяцев лечения он снизился на 5,7% и через 12 месяцев – на 10,2%, при этом общее сосудистое сопротивление вначале терапии повышалось на 10,6%, а далее возвращалось к исходному уровню. В совокупности эти данные указывают на то, что атенолол влияет на гемодинамические показатели, как все классические бета1-адренергические блокаторы, для которых характерно отрицательное инотропное действие, снижение работы левого желудочка и умеренное повышение периферического сосудистого сопротивления. Некоторое снижение индекса Пурсела под влиянием атенолола можно объяснить уменьшением силы кинетического стресса на сосудистую стенку. Четыре гемодинамических параметра определяют гемодинамический стресс: кровяное давление, скорость тока крови, ЧСС и размер сосуда. Под влиянием атенолола снижается САД, ЧСС и скорость тока крови, однако размер сосуда практически не меняется.
Рис. 3. Эффект небиволола и атенолола на максимальный кровоток в плечевой артерии (р<0,05)
Заключение
Циркулирующие цитокины при СН могут стимулировать синтез индуцибельной NOS2 в сосудистых и, особенно, в гладкомышечных клетках, увеличивая степень СН [9]. Об этом свидетельствует увеличение нитратов при СН.
Таким образом, регуляция секреции NO вносит изменения в сердечную недостаточность, но, вероятно, больше качественные, чем количественные.
Этот комплекс функционального ремоделирования с неподходящим перераспределением роли эндотелиальной NOS и индуцибельной NOS2, определяет трудности в интерпретации данных фармакологических исследований при застойной сердечной недостаточности. Имеются данные о кровоток-зависимом снижении ответа на ацетилхолин и прямые доноры NO и увеличение чувствительности к аргининовым антагонистам NO синтазы у этих больных [10, 11]. Эти результаты можно интерпретировать как функциональное перемещение секреции NO от специфической эндотелиальной продукции, в ответ на кровоток, к возможному повышению секреции вследствие декомпартментализации и нерегулируемого давления растяжения при СН. Эта декомпартментализация в продукции NO синтазы может определять не способность больных с СН справляться с физической нагрузкой. Использование стимуляторов эндотелиальной функции активирует эндотелиаль-ную NO синтазу [11]. И это, возможно, объясняет положительное действие небиволола – в частности, на сердечный выброс, и, в целом, на процессы ремоделирования и показатели миокардиального стресса у больных сердечной недостаточностью, несмотря на то, что классически для бета-блокаторов характерен обратный эффект [10, 11].
NO играет роль в регуляции распределения кровотока в ответ на метаболические расстройства. При сердечной недостаточности эндотелий не может корректно продуцировать NO в соответствии с метаболическими изменениями. Препараты, стимулирующие продукцию NO в эндотелии, могут восстанавливать эту его функцию [10].
Кардиоселективные бета-адреноблокаторы уменьшают системную сосудистую резистентность и увеличивают сердечный выброс у больных с СН. Эндотелий-зависимые эффекты бета-блокаторов включают: увеличение выработки вазодилятаторных простагландинов, облегчение выработки эндотелий-зависимых релаксирующих факторов за счет подавления выработки и/или действия циркулирующих катехоламинов и подавления выработки и/или действия Эндотелий-зависимых контрактирующих факторов за счет уменьшения гипоксии. Однако, ни один из используемых препаратов не может прямо воздействовать на эндотелий-зависимую релаксацию [12, 13].
Эндотелий-зависимые эффекты небиволола связаны не только с блокадой бета1-адренергических рецепторов, но и с увеличением выработки эндотелий-зависимого расслабляющего фактора NO, то есть с прямым воздействием на эндотелий сосудов. В предыдущих работах in vivo было показано, что вазодилагация сосудистого ложа плеча осуществляется через воздействие комплекса L-аргинин/NО [14]. Эндотелиальная дисфункция является одним из ранних признаков тяжелых форм сосудистой патологии и прямой эффект небиволола на сосудистый эндотелий в сочетании с кардиоселективной бета-блокирующей активностью может значительно улучшать органную перфузию и снижать летальность при сердечно-сосудистых заболеваниях.
Литература:
1. Мареев В.Ю. Изменение стратегии лечения хронической сердечной недостаточности. Время бета-адреноблокаторов. Кардиология, 1998; 38: 4-12.
2. Cohn J.N. Drug therapy: the management of chronic heart failure. N. Engl. J. Med., 1996; 335: 490-498.
3. Ferrari R., Ceconi С., Curello S. et al. The neuroendocrine and sympathetic nervous system in congestive heart failure. Eur. Heart J., 1998; 19: SupplF: 45-51.
4. Малышев И.Ю., Манухина Е.Б. Стресс, адаптация и оксид азота. Биохимия. 1998; 63: 992-1006.
5. Haynes W.G., Ferro C.E., Webb D.J. Physiologic role of endothelin in maintenance of vascular tone in humans. J. Cardiovasc. Pharmacol. 1995; 26: Suppl 3: 183-185.
6. Cooke J.P. The endotelium: a new target for therapy. Vase. Med. 2000; 5: 49-53.
7. Небилет (Небиволол): клиническая фармакология и международный опыт применения. Под редакцией Н.А. Мазура. М. 2000; 52.
8. Feigenbaum Н. Echocardiography. 5th Ed. Philadelphia. 1994: 695.
9. Sharma R., Coats A.J., Anker S.D. The role of inflammatory mediators in chronic heart failure: cytokines, nitric oxide, and endothlin-1. Int. J. Cardiol. 2000; 72: 175-186.
10. Michel J.B. Nitric Oxide and cardiovascularhomeostasis. Firenze: Menarini International, 1999: 31.
11. Манухина Е.Б., Малышев И.Ю. Роль оксида азота в сердечно-сосудистой патологии: взгляд патофизиолога. Российский кардиологический журнал. 2000; 25: 55-63.
12. Goldstein М., Vincent J-L., De Smet J-M. Administration of nebivolol after coronary artery bypass in patients with altered left ventricular function. J. Cardiovasc. Pharmacol. 1993; 22: 253-258.
13. Marceau M., Lacourciere Y. Effects of nebivolol and atenolol on regional and systematic hemodynamics at rest and during exercise in hypertensive subjects. Am. J. Hypertens. 1998; 11: 993-2001.
14. Cockoft JR., Brett SC., Chen C.H.PL-H. Nebivolol vasodilates human foream vasculature: evidence for L-arginine/NO-dependent mechanism. J. Pharmacol. Exp. Therap. 1995; 274: 1067-1071.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
