Экспериментальная модель инфаркта миокарда
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Джиджихия К.М.
1
Каде А.Х.
1
Занин С.А.
1
Трофименко А.И.
1
Синявцева В.К.
1
Джиджихия З.М.
1
1 ГБОУ ВПО «Кубанский государственный медицинский университет Минздрава Российской Федерации»
Инфаркт миокарда занимает лидирующие позиции в структуре смертности и инвалидизации населения всего мира. Такое обстоятельство привлекает внимание клиницистов и экспериментаторов, разрабатывающих различные методы защиты миокарда от аноксического повреждения – кардиопротекция. Как правило, механизмы кардиопротекции изучаются на экспериментальных лабораторных моделях. В статье описывается последовательность оперативных манипуляций для получения экспериментальной модели на живых крысах. Эксперименты проведены на 20 нелинейных крысах, которым после наркоза моделировали некроз сердечной мышцы посредством перевязки задней межжелудочковой ветви правой коронарной артерии. Подтверждение инфаркта миокарда осуществляли при помощи электрокардиографического и гистологического исследования. Таким образом, предложенный нами метод получения модели инфаркта миокарда на крысах может успешно использоваться в экспериментальной практике, в частности, для изучения механизмов кардиопротекции.
экспериментальный инфаркт миокарда
доступ к сердцу
гистологическая картина
1. Западнюк И.П., Западнюк В.И., Захария Е.А., Западнюк Б.В. Лабораторные животные. Разведение, содержание, использование в эксперименте. – Киев.: Вища школа, 1983. – 383 с.
2. Кушаковский М.С. Аритмии сердца: руководство для врачей. 2-е изд., доп., расшир. и част. перераб. – СПб.: ИКФ «Фолиант», 1998. – 640 с.; ил.
3. Лопухин Ю.М. Экспериментальная хирургия. – М.: Медицина, 1971. – 346 с.
4. Орлов В.Н. Руководство по электрокардиографии. – М., 1983. – 67 с.
5. Российские рекомендации. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. – 2007. – ВНОК.
6. Трофименко А.И. Моделирование церебральной ишемии посредством коагуляции средней мозговой артерии у крыс / А.И. Трофименко, А.Х. Каде, В.П. Лебедев [и соавт.] // Фундаментальные исследования. – 2012. – № 2. – С. 215–218.
Инфаркт миокарда (ИМ) представляет собой некроз определенного участка сердечной мышцы, в основе которой практически во всех случаях лежит тромбоз атеросклеротически измененных коронарных артерий [5]. Тромб, образующийся на поверхности атеросклеротической бляшки, может закупорить просвет сосуда как частично, так и полностью. В последнем случае будет развиваться ИМ с зубцом Q [5]. В каждом третьем случае ИМ заканчивается летально [5]. В связи с тем, что на сегодня смертность и инвалидность от ИМ очень высока, она представляет не только медицинскую, но и огромную экономическую и социальную проблему для всех стран.
В свете открытия новых научных данных на основе множества экспериментальных работ в кардиологии появляется новое направление – кардиопротекция – комплекс мероприятий, направленных на повышение устойчивости миокарда к гипо-/аноксическому повреждению, которые позволили бы максимально уменьшить зону ИМ и снизить риск развития осложнений, связанных с ним. Основным способом изучения механизмов кардиопротекции является моделирование ИМ в эксперименте. В последнее время наиболее популярен метод экстирпации сердца с использованием ретроградной перфузии по Лангендорфу. На наш взгляд, подобные методы с экстирпацией органа не позволяют учитывать влияния центральной нервной системы (и других систем в том числе) на патогенез ИМ, в связи, с чем мы считаем, что лучше использовать модели с живыми организмами, которые позволили бы максимально приблизить экспериментатора к реальным условия течения болезни. При этом подобные модели должны обладать высокой степенью воспроизводимости ИМ, минимальной смертностью животных во время эксперимента, простотой выполнения эксперимента в техническом плане, а также возможностью параллельно регистрировать дополнительные параметры и забора ткани сердца для последующего анализа. Следует указать, что и подобные экспериментальные модели не могут дать полную картину ИМ в силу того, что у человека к заболеванию приводит долгий, иногда многолетний период развития доклинических процессов, а у животного в результате экспериментального воздействия возникает на фоне полного здоровья и активности компенсаторно-приспособительных реакций [5].
Цель работы: создание операционной модели ИМ в остром эксперименте на крысах с целью последующего изучения механизмов кондиционирования сердца.
Материалы и методы исследования
Эксперименты по моделированию ИМ были проведены в лаборатории кафедры общей и клинической патофизиологии ГБОУ ВПО КубГМУ Минздрава России. В исследование было включено 20 нелинейных крыс (обоих пола) со средней массой 180 ± 20 грамм. Животные содержались в виварии в соответствии с «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических помещений (вивариев)», утвержденным МЗ СССР 06.04.73 г. и приказом МС СССР от 10.03.66 г. № 163 [1]. Эксперимент начинали с введения наркозной смеси, состоящей из 0,03 мг золетила в/м, 0,8 мг ксиланита в/м, 0,01 мл 0,1 % р-ра атропина п/к на 100 г веса животного [6]. Протекция внешнего дыхания была выполнена с помощью аппарата ИВЛ «Вита-1». Электрическая активность сердца регистрировалась на электрокардиографе ЭК 1Т-1/3-07 «АКСИОН» в стандартных отведениях [4]. Оперативный доступ был проведен в следующей последовательности: этап № 1 (рис. 1а) – скальпелем в продольном направлении рассекали кожу груди, начиная с точки выше верхнего края грудины на 5 мм и продолжая разрез вниз на 4–5 см, и препарировали ее от подлежащих тканей. Двумя полулунными разрезами с обеих сторон от грудины кожный лоскут удаляли. Этап № 2 (рис. 1б) – пересекали поверхностную и глубокую грудные мышцы в местах их фиксации (клювовидный отросток лопатки, дельтовидная бугристость плечевой кости и грудина). Таким образом, осуществлялся разрез треугольной формы, после чего обнажалась передняя поверхность рёбер.
а б
Рис. 1. Этапы операции: а – 1 этап; б – 2 этап
Этап № 3 (рис. 2а) – двумя поперечными разрезами (1,5–2 см) в III и IV межреберных промежутках аккуратно рассекали наружные и внутренние межреберные мышцы, не допуская повреждения расположенных рядом сосудов и предупреждая тем самым кровотечение из них. IV ребро с прилегающим участком грудины удалялось, после чего формировалось «окошко» грудной полости. Этап № 4 (рис. 2б) – Т-образным разрезом вскрывали перикард. Сердце вывихивали в сформированное «окошко». Зацепив анатомическим пинцетом верхушку сердца, ротировали ее против часовой стрелки, после чего обнажалась задняя поверхность, на которой четко визуализировалась задняя межжелудочковая ветвь правой коронарной артерии. Под нее подводили лигатуру атравматической иглой, после чего лигатуру затягивали. Кровоток по данной артерии прекращался полностью [3].
а б
Рис. 2. Этапы операции: а – 3 этап; б – 4 этап
Результаты исследования и их обсуждение
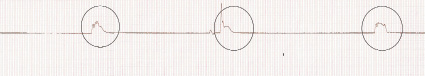
Верификация ишемии миокарда проводилась с помощью электрокардиографии и гистологического исследования биоптатов миокарда. На 1-й минуте регистрации ЭКГ появляются единичные экстрасистолы за счет включения триггерной активности и появления ранних постдеполяризаций [2].
На 3-й минуте продолжают регистрироваться экстрасистолы, но уже по типу тригеминии (включение механизма поздней постдеполяризации) [2].

На 6-й минуте регистрируются признаки ишемического повреждения миокарда (на ЭКГ ‒ элевация сегмента S-T).

На 10-й минуте появляются отдельные желудочковые сокращения, что свидетельствует об атриовентрикулярной диссоциации (патологическая автоматия и декрементное проведение импульса) [2].
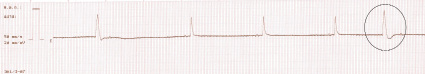
И на 15-й минуте регистрации ЭКГ идиовентрикулярный ритм; асистолия.

Нами проведено гистологическое исследование ткани сердца умерших животных. У животных выделяли сердце, ополаскивали их 2-кратно в холодном 0,9 % растворе хлорида натрия, далее проводили фиксацию органов в 10 % нейтральном формалине, с последующей проводкой в изопропаноле, заливкой образцов в парафин и приготовлением срезов и стекол. Окрашивание полученных стекол выполняли гематоксилином-эозином. Ниже представлена гистологическая (увеличение объектива в 10 и 100 раз) картина изменений сердца животных.
При увеличении в 10 раз (рис. 3а) мы видим разволокнение миокарда (А), резкое полнокровие крупных сосудов (Б) и сосудов микроциркуляторного русла (В), что свидетельствует об ишемическом повреждении миокарда. На рис. 3б представлено 100-кратное увеличение ткани миокарда. Здесь также прослеживается резкое полнокровие сосудов и нарушение микроциркуляции по типу «монетных столбиков» (Г), деградация миофибрилл и их разнонаправленность (Д). Все представленные гистологические данные свидетельствуют об острой гипоксии в результате ишемического повреждения миокарда.
а б
Рис. 3. Гистологическая картина миокарда крыс: а – увеличение в 10 раз; б – увеличение в 100 раз
Вывод
Таким образом, предложенный нами метод получения ИМ на крысах может успешно использоваться в экспериментальной практике, в частности, для изучения механизмов кардиопротекции. Оправданность широкого применения предложенной модели ИМ и ее преимущества перед другими методами заключается в том, что, с одной стороны, метод не требует специального инструментального оснащения и специфических мануальных навыков от экспериментатора, а с другой, ИМ воспроизводится в 100 % случаев, что подтверждается данными ЭКГ и гистологического исследования ткани сердца. Кроме того, интраоперационная смертность животных в нашем эксперименте отсутствовала.
Рецензенты:
Шантыз А.Ю., д.б.н., профессор кафедры анатомии, ветеринарного акушерства и хирургии, ФГБОУ ВПО «Кубанский государственный аграрный университет», г. Краснодар;
Могильная Г.М., д.м.н., профессор, зав. кафедрой гистологии с эмбриологией, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Работа поступила в редакцию 21.10.2013.
Библиографическая ссылка
Джиджихия К.М., Каде А.Х., Занин С.А., Трофименко А.И., Синявцева В.К., Джиджихия З.М. ЛАБОРАТОРНЫЙ СИНТЕЗ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ ИНФАРКТА МИОКАРДА У КРЫС // Фундаментальные исследования. – 2013. – № 12-3. – С. 461-465;
URL: https://fundamental-research.ru/ru/article/view?id=33429 (дата обращения: 14.10.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Большов П.С.
1
Чижмак А.О.
1
Мульский С.В.
1
Куликова С.Г.
1
1 ГБОУ ВПО Кубанский государственный медицинский университет Министерства здравоохранения Российской Федерации
Одним из наиболее грозных заболеваний сердечно-сосудистой системы является инфаркт миокарда. Новым подходом в терапии инфаркта миокарда может стать стимуляция процессов органотипической репаративной регенерации, что требует проведения исследований, в том числе и на in vivo моделях инфаркта миокарда. В связи с этим, целью нашей работы является разработка модели инфаркта миокарда у крыс пригодной для хронического эксперимента. В результате проведенного исследования было показано, что модель инфаркта миокарда пригодная для хронического эксперимента в области исследования процессов органотипической регенерации миокарда должна быть максимально малоинвазивной, так как даже применение щадящей межреберной торакотомии сопряжено с формированием большого числа интраоперационных осложнений в основном связанных с дефектами операционной техники и герметизации грудной полости.
инфаркт миокарда
крыса
хроническая модель
эксперимент
1. Галенко-Ярошевский А.П., Туровая А.Ю., Городжая Г.Г. Влияние РУ-353 на содержание биогенных аминов, ацетилхолина и активность ацетилхолинэстеразы в миокарде и различных отделах головного мозга крыс // Бюллетень экспериментальной биологии и медицины. – 2002. – П. 2. – С. 58–62.
2. Джиджихия К.М. Лабораторный синтез экспериментальной модели инфаркта миокарда у крыс / К.М. Джиджихия, А.Х. Каде, С.А. Занин [и соавт.] // Фундаментальные исследования. – 2013. – № 12. – Ч. 3. – С. 461–465.
3. Джиджихия К.М. Получение модели крупноочагового инфаркта миокарда в остром эксперименте на крысах / Джиджихия К.М., Каде А.Х., Занин С.А., Самоследова Д.А., Джиджихия З.М. // Фундаментальные исследования. – 2012. – № 4–2. – С. 270–273.
4. Трофименко А.И. Влияние ТЭС-терапии на исходы острого адреналинового повреждения сердца у крыс / А.И. Трофименко, А.Х. Каде, В.П. Лебедев [и соавт.] // Кубанский научный медицинский вестник. – 2013. – № 5 (140). – С. 174–180.
5. Трофименко А.И. Гистологическая картина миокарда при адреналиновом повреждении сердца у крыс / А.И. Трофименко, А.Х. Каде, С.А. Занин [и соавт.] // Международный журнал прикладных и фундаментальных исследований. – 2013. – № 7. – С. 135–138.
6. Трофименко А.И. Особенности электрокардиограммы у крыс с моделью церебральной ишемии, вызванной посредством коагуляции правой средней мозговой артерии // А.И. Трофименко, А.Х. Каде, В.П. Лебедев [и соавт.] // Кубанский научный медицинский вестник. – 2012. – № 2 (131). – С. 175–179.
7. Трофименко А.И. Моделирование церебральной ишемии посредством коагуляции средней мозговой артерии у крыс / А.И. Трофименко, А.Х. Каде, В.П. Лебедев [и соавт.] // Фундаментальные исследования. – 2012. – № 2. – Ч. 1. – С. 215–218.
8. Трофименко А.И. Влияние ТЭС-терапии и агонистов пурин-эргической стресс-лимитирующей системы на течение адреналиновой кардиомиопатии у крыс в эксперименте / А.И. Трофименко, А.Х. Каде, С.А. Занин, Ю.В. Дынько // Вестник МУЗ ГБ № 2. – 2013. – № 5 (29); URL: http: //vestnik.kmldo.ru/pdf/13/05/02.pdf (дата обращения: 03.11.2013).
9. Трофименко А.И. Гистологическая картина миокарда у крыс с моделью церебральной ишемии, вызванной коагуляцией правой средней мозговой артерии / А.И. Трофименко, А.Х. Каде, С.А. Занин, Ю.В. Дынько // Вестник МУЗ ГБ № 2. – 2012. – № 5 (23); URL: https://vestnik.kmldo.ru/pdf/12/05/02.pdf (дата обращения: 08.10.2012).
10. Туровая А.Ю., Кигурадзе М.И., Галенко-Ярошевский П.А., Каде А.Х., Уваров А.В., Татулашвили Д.Р., Сукоян Г.В. Cостояние симпатико-адреналовой системы и соотношения нейроактивных аминокислот в продолговатом мозге крыс под влиянием неселективных β-адреноблокаторов // Бюллетень экспериментальной биологии и медицины. – 2005. – Т. 139, № 5. – С. 525–527.
Заболевания сердечно-сосудистой системы являются ведущей причиной инвалидизации и смертности в Российской Федерации. Одним из наиболее грозных проявлений патологии сердечно-сосудистой системы является инфаркт миокарда [2, 3]. Новым подходом в терапии инфаркта миокарда может стать стимуляция процессов органотипической репаративной регенерации, что требует проведения исследований, в том числе и на in vivo моделях инфаркта миокарда [1, 10].
Цель работы – разработка модели инфаркта миокарда у крыс пригодной для хронического эксперимента.
Материалы и методы исследования
Исследование проведено в лаборатории кафедры общей и клинической патофизиологии ГБОУ ВПО КубГМУ. Эксперименты проведены на 10 белых нелинейных крысах средней массой – 280 ± 30 гр. Содержание животных и постановка экспериментов проводилась в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 года и № 267 МЗ РФ от 19.06.2003 года, а также международными правилами «Guide for the Care and Use of Laboratory Animals». Все потенциально болезненные сопровождались использованием золетил-ксилазинового наркоза по следующей схеме: золетил 0,3 мг в/м («Virbac» Франция), ксиланит 0,8 мг в/м (ЗАО «НИТА-ФАРМ, Россия, г. Саратов), атропина сульфат 0,1 % раствор – 0,01 мл п/к из расчета на 100 гр. массы тела животного [7]. Наркоз верифицировали по исчезновению реакции на болевые раздражители (укол лапы) и угнетению роговичного рефлекса. Регистрацию электрокардиограмм у крыс проводили на электрокардиографе ЭК 1Т- 1/3- 07 «АКСИОН» в стандартных отведениях I, II, III (двухполюсные отведения от конечностей): I – левая и правая передние конечности, II – левая задняя и правая передняя конечности, III – левая задняя и левая передняя конечности) в положении на спине, с использованием игольчатых электродов помещаемых подкожно на конечности [6].
Операция проходила с помощью искусственной вентиляции легких через трахеостому с использованием аппарата «ВИТА-1» (СССР). Доступ к сердцу осуществлялся за счет межреберной торакотомии. Предварительно в связи с относительно высокой частотой декстрокардии у крыс проводили пальпаторное определение локализации верхушечного толчка. Торакотомия выполнялась в 6 межреберье. При ревизии плевральной полости вскрывался перикард, с помощью надавливания на грудную клетку сердце пролабировало в рану, с помощью ватных палочек осуществляли разворот сердца. Под левую венечную артерию подведена игла атравмат (шелк 7/0), произведена перевязка артерии. Выполнялся прокол грудной клетки в 8 межреберье противоположной стороны, установлен плевральный дренаж. В дальнейшем проводилось послойное ушивание торакотомной раны непрерывными швами. С помощью шприца через дренаж аспирирован воздух из плевральной полости, после чего плевральный дренаж удален. П-образным швом ушита трахея. После удаления дыхательной трубки шов затянут, проведено послойное ушивание раны непрерывным швом. Проводилась послеоперационная антибиотикотерапия с использование бициллина-5 из расчета 30 тыс. ЕД на 100 гр. веса тела животного. У крыс переживших создание модели проводилась эвтаназия на 14 сутки с забором сердца.
Сердце разрезалось по длиннику вдоль полостей, быстро промывалось в холодном растворе 0,9 % натрия хлорида и подвергалось фиксации в 10 % нейтральном забуференном фосфатами формалине. Выполнялась проводка образцов через изопропанол-минеральное масло, с последующей заливкой в парафин. В дальнейшем изготавливались парафиновые блоки, проводилась их нарезка на микротоме МПС-2 (СССР) на срезы толщиной 10 мкм. Проводилось монтирование срезов на предметные стекла с адгезивным покрытием. Микропрепараты окрашивались гематоксилином-эозином и по Маллори [4, 5, 8, 9]. Заключение под покровное стекло проводилось в пихтовый бальзам. Полученные микропрепараты фотографировали с помощью окулярной камеры «Levenhuk 230» (США) на микроскопе Микромед-6 (Россия).
Результаты исследования и их обсуждение
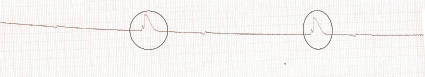
При анализе причин смерти животных выяснено, что 4 крысы погибли интраоперационно ввиду повреждения крупных магистральных сосудов и кровотечения. У всех крыс начиная с момента перевязки левой венечной артерии определялись электрокардиографические признаки ишемии миокарда, в виде появления и подъема сегмента ST [4]. Причиной гибели 3-х крыс послужили дефекты установки трахеостомической трубки и ушивания трахеи. У двух крыс летальный исход развился на 1 и 3 сутки соответственно, при этом как клинически, так и секционно выявлена картина тяжелой сердечной недостаточности. При исследовании микропрепаратов сердца видна картина глыбчатого распада кардиомиоцитов с исчезновением поперечной исчерченности, ядра прокрашивались плохо данные явления могут быть объяснены процессами аутолиза, так как забор сердца у погибшего животного выполнялся после обнаружения трупа в клетке.
Только одна крыса нормально перенесла оперативное вмешательство по созданию модели инфаркта миокарда, ее эвтаназия с забором гистоматериала была проведена на 14 сутки от начала эксперимента. В миокарде при окрашивании четко выявляется зона свежей соединительной ткани в области кровоснабжения левой венечной артерии.
Выводы
В результате проведенного исследования было показано, что модель инфаркта миокарда пригодная для хронического эксперимента в области исследования процессов органотипической регенерации миокарда должна быть максимально малоинвазивной, так как даже применение межреберной торакотомии сопряжено с формированием большого числа интраоперационных осложнений в основном связанных с дефектами операционной техники и герметизации грудной полости.
Библиографическая ссылка
Большов П.С., Чижмак А.О., Мульский С.В., Куликова С.Г. РАЗРАБОТКА МОДЕЛИ ИНФАРКТА МИОКАРДА В ХРОНИЧЕСКОМ ЭКСПЕРИМЕНТЕ У КРЫС // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 5-1. – С. 52-53;
URL: https://applied-research.ru/ru/article/view?id=6758 (дата обращения: 14.10.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
