Ишемический инсульт при химиотерапии

Результаты научных исследований, проведенных в последние годы, говорят о том, что между онкологическими заболеваниями и инсультом есть взаимосвязь. В данной статье мы попробуем разобраться, каким образом рак способствует возникновению мозгового удара, и разберем результаты некоторых научных работ, посвященных этой теме.
Онкологические заболевания возникают, когда клетки из-за генетических нарушений, вызванных теми или иными причинами, начинают бесконтрольно размножаться. Не всякую опухоль можно назвать злокачественной. В отличие от доброкачественных новообразований, как правило, не представляющих большой опасности, рак способен прорастать в соседние органы и давать метастазы.
Однако, патологические изменения не ограничиваются только местом, в котором находится злокачественная опухоль. Затрагивается весь организм. Это происходит по нескольким причинам:
- Раковые клетки выделяют в общий кровоток продукты обмена, которые могут наносить вред органам и тканям.
- На опухоль начинают реагировать иммунные клетки, они тоже выделяют некоторые биологически активные вещества.
- Свою лепту вносит системная химиотерапия. Когда химиопрепарат вводят в вену или принимают в виде таблеток, он распространяется по всему организму и атакует не только опухолевые, но и другие активно размножающиеся клетки.
Системные расстройства, которые возникают в организме из-за присутствия злокачественной опухоли, называются паранеопластическим синдромом.
Паранеопластические синдромы бывают четырех основных видов, в зависимости от того, в какой системе организма происходят нарушения:
- эндокринные;
- неврологические;
- кожно-слизистые;
- гематологические.
Нас интересует последняя группа паранеопластических синдромов – гематологические, связанные с нарушениями со стороны крови. В частности, рак способен повышать свертываемость крови, что, как известно, может привести к ишемическому инсульту.
Рак и инсульт: исследование Кристофера Шварцбаха
Команда ученых из Гейдельбергского университета в Германии под руководством доктора медицинских наук Кристофера Шварцбаха (Christopher J. Schwarzbach) в 2012 году обнаружила, что у онкологических больных имеется неизвестный фактор риска, из-за которого повышается вероятность инсульта.
У людей, которые не страдали онкозаболеваниями, к мозговому удару чаще приводили известные факторы риска, такие как артериальная гипертензия, атеросклероз. У онкобольных, перенесших инсульт, эти факторы встречались реже, но, по-видимому, играл большую роль другой, неизвестный фактор.
Сам Кристофер Шварцбах отметил:
Наше исследование является самым крупным в этой теме, включавшим сравнение с контрольной группой, и полученные данные укрепляют концепцию гиперкоагуляции [повышенной свертываемости крови], связанной с раком…
…Клиницисты должны знать об этом потенциальном риске и важном механизме возникновения инсульта, даже если речь идет о пожилых людях, у которых есть другие факторы риска, например, атеросклероз.
Рак и гиперкоагуляция

Ученые уже давно рассматривают онкологические заболевания как гиперкоагуляционные состояния. Однако, исследований, посвященных связи между онкозаболеваниями и риском инсульта, было проведено немного, их результаты неоднозначны.
Во время исследования в 2012 году ученые под руководством Кристофера Шварцбаха собрали данные о 140 пациентах, имевших злокачественные опухоли и перенесших инсульт, проходивших лечение с 2002 по 2011 гг. Также были проанализированы данные 140 пациентов, которые перенесли инсульт, но не страдали онкологическими заболеваниями.
Всех пациентов разделили на две группы:
- Люди, у которых инсульт произошел на фоне известных факторов риска – «обычный» инсульт.
- Люди, у которых инсульт произошел по неизвестным причинам – предположительно из-за онкологического заболевания.
Оказалось, что инсульт по неизвестным причинам значительно чаще происходил у людей, страдавших онкологическими заболеваниями (48% случаев), чем у людей, которые не имели рака (27% случаев).
Также у онкобольных чаще встречались тромбозы глубоких вен ног и тромбоэмболия легочной артерии (8% случаев против 1%).
У онкологических больных, которые перенесли инсульт по неизвестным причинам, метастазы встречались чаще (59%), чем у онкологических больных, перенесших «обычный» инсульт (28%).
У онкологических пациентов ишемический инсульт значительно чаще происходил в областях головного мозга, которые получают кровь из нескольких разных сосудов или из одного сосуда небольшого размера.
Эти данные подтверждают гипотезу эмболии проксимальных артерий, состояния, которое может быть связано с повышением свертываемости крови при раке.
Из исследования Кристофера Шварцбаха следуют два важных вывода:
- Онкологическим пациентам, имеющим подозрение на повышенную свертываемость крови, нужно проходить скрининг на тромбоэмболические осложнения, такие как тромбоз глубоких вен.
- Если у человека случился инсульт по неизвестным причинам (такую разновидность инсульта называют криптогенной), ему стоит пройти скрининг на онкологические заболевания.
С полным текстом исследования Кристофера Шварцбаха 2012 года в научном журнале Stroke можно ознакомиться по ссылке (статья на английском языке).
Исследование 2017 года: рак после инсульта

В 2017 году ученые из Мадрида под руководством доктора Якобо Рогадо (Jacobo Rogado) проанализировали данные 381 пациента, которых госпитализировали в период с 2012 по 2014 гг. с диагнозом «инсульт». У 29 из них был обнаружен рак.
Исследователи обнаружили, что у всех больных, у которых диагностировали злокачественные опухоли, в крови был повышен уровень фибриногена – белка, принимающего участие в процессе свертывания.
Известно, что многие типы рака на ранних стадиях не имеют симптомов. Опухоль может расти годами и оставаться незамеченной. Ученые считают, что у участников данного исследования рак был еще до того, как произошел инсульт. Опухоль привела к повышению уровня фибриногена и мозговому удару, но сама начала проявляться существенно позже. Поэтому на первый взгляд могло показаться, что рак у этих людей возник после инсульта.
Более подробно исследование ученых из Мадрида описано в отдельной статье на нашем сайте.
Источник
Уважаемые врачи ! Помогите мне, пожалуйста! Мне посоветовали к вам обратиться на одном из форумов об инсульте. Скажу сразу, что я живу в США, а мама в России. Проконсультироваться мне НЕ У КОГО. Я просто в отчаянии. Выехать не могу, жду документ, позволяющий мне путешествовать.
Возможно то, что предшествовало инсульту имеет значение, поэтому начну по порядку.
Моей маме 60 лет. В марте 2009 года у неё был диагностирован рак груди 3 степени. 26 июня 2009 была проведена операция по удалению груди. С момента диагностирования мама прошла 6 курсов химиотерапии, последний был в середине сентября. 6 октября она должна была лечь в больницу на облучение. Но доктор не стала её ложить из-за маминого плохого самочувствия, а отправила домой. С 7 октября самочувствие мамы стало ешё хуже, она практически перестала есть и почти всё время лежала, тошнота и рвота были по 6 раз в день. 9 октября к ней приходила невропатолог, но никаких отклонений не нашла. С 11 октября мама перестала есть вообще, а тошнота и рвота наступали через каждый час + сильные головные боли. 14 октября или несколько раньше врач прописала маме Метаклопромид таблетки. 0.01г. и Дексаметазон уколы амп. 2мл. К 15 октября тошнота и рвота наступали через каждые 15 минут. Единственный раз, когда она почувствовала себя получше был четверг 15 октября. Она поела, написала мне короткое письмо, сообщив, что чувствует себя получше и что тошнота немного отступила, но полностью не прошла. 16 октября самочувствие опять стало очень плохим.
На утро субботы 17 октября 2009 года у неё был назначено обследование – МРГ головного мозга. Обследование назначил мамин лечащий врач – химиотерапевт, у которого было подозрение, что мамино плохое самочувствие было следствием опухоли/метастаз мозга. Мой брат отвёз маму на МРТ, где врач, проводивший тест, сказал, что результаты нормальные и соответствуют возрасту. Заключение специалиста по МРТ можно увидеть здесь:
https://picasaweb.google.com/lh/photo…eat=directlink
Вечером в субботу 17 октября 2009г, мой брат, вернувшись с работы, обнаружил маму в ужасном состоянии – она никого не узнавала, не говорила и водила по воздуху руками. Только через несколько часов после вызова скорой ТРЕТЬЯ по счёту скорая забрала маму в больницу. В больнице ей был поставлен диагноз инсульт. Если я правильно поняла что написано в справке: ОМНК по ишемическому типу в системе корковых ветвей левой СМА (среднемозговой артерии) с афатическими растройствами. Энцефалопатия смешенного генеза II-III стадии, когнитивные, и эмоционально волевые нарушения. Тут оригинал справки:
https://picasaweb.google.com/lh/photo…eat=directlink
. Сейчас врач говорит, что энцефалопатия III стадии.
В настоящий момент (29 октября 2009) мама 12 дней как находится на лечении в неврологическом отделении в больнице. Поначалу она никого не узнавала, затем через три дня ей стало немного получше и она стала кушать (с помощью). И хотя речь к ней потихоньку возвращается, говорит она очень мало, как правило фразами из одного-двух-трёх слов. Она жалуется на сильные головные боли и боли в шее. После двух дней нахождения в больнице (попала в выходные – врачей нет), стали вводить внутривенно КАВИНТОН, физраствор, УФЕЛИН и глюкозу. Сейчас делают утром внутривенно ДИМЕДРОЛ и АНАЛЬГИН. Давление у моей мамы обычно пониженное, но сейчас в больнице 120/80.
Руки, ноги не парализованы. Не может удержать равновесие, даже сидя. Садиться пока не разрешают. 27 окт. приходил специалист по лечебной физкультуре, но заниматься не смог, потому как упражнения вызывают сильные боли в шее/голове.
Кроме рентгена лёгких, не было проведено ни МРТ ни КТ, ни каких либо других обследований. Врач говорит, что “больную пока нельзя трогать”. Рентген делали 24 октября, результаты нормальные/удовлетворительные.
23-24 октября она перестала кушать, даже если её кормят. Говорит, что очень сильно болит шея и голова. Не хочет сама держать бутылочку с водой или ложку. Не хочет переворачиваться и делать то, что пыталась делать несколько дней назад.
Дополнение: Сегодня 29 октября была сделана МРТ. Врач сказала, что у мамы в больнице был повторный инсульт, который скорее всего был 27 октября. Мама вернулась к тому же состоянию, в котором она была доставлена в больницу 17 октября. Сейчас ей дают МАНИТ 400 мл и физраствор 200 мл. Врач сказала, что у мамы могут быть метастазы мозга, которые не видны на МРТ.
Шокировало больше всего то, что как сказала сегодня врач, МРТ, которая была сделана ещё 17 октября, показала, что у моей мамы уже БЫЛ ИНСУЛЬТ!, но несмотря на это её просто отправили домой!
Уважаемые врачи, каково ваше мнение и что бы вы посоветовали нам предпринять в самое ближайшее время и чуть позже? Есть ли какие-либо прогнозы о возможном развитии состояния моей мамы? На мой вопрос о редких или дорогих лекарствах, которые могли бы помочь, лечащий врач ответила, что ничего не нужно. Ответьте мне, пожалуйста!!! Или посоветуйте, куда можно обратиться за помощью! Опубликовала свой вопрос на 9-ти медицинских форумах об инсульте, ответил только 1 человек, и то посоветовал обратиться к вам.
Спасибо заранее. Ольга.
Источник
Материалы для сайта подготовлены сотрудниками лаборатории клинических проблем атеротромбоза Института Кардиологии им. А.Л.Мясникова


Ишемическая болезнь сердца
Ишемия миокарда, реже – инфаркт миокарда или аритмии, индуцированные ишемией, являются побочными эффектами ряда методов лечения онкозаболеваний. В основе этих осложнений лежит целый спектр механизмов: от прямого индуцирования вазоспазма, эндотелиального повреждения и развития артериального тромбоза до долгосрочных изменений метаболизма липидов и, соответственно, преждевременного развития атеросклероза (таблица 1). Лучевая терапия на область средостения может усугублять поражение коронарных артерий, вызванное химиопрепаратами.
Таблица 1. Патофизиологические механизмы развития ИБС на фоне лечения онкозаболеваний.
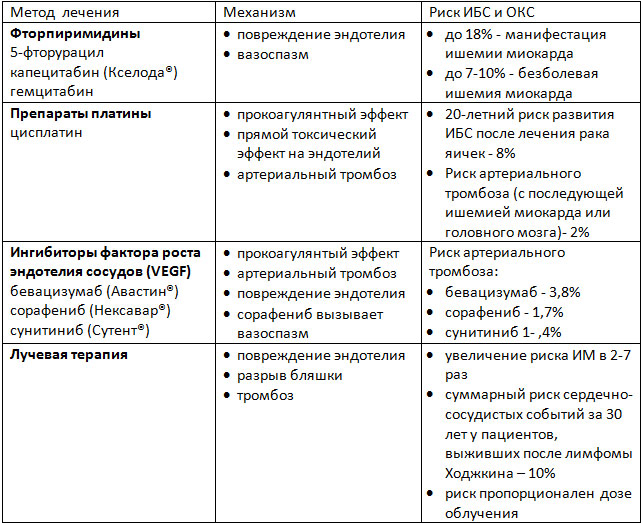
Фторпиримидины
Фторпиримидины (такие как 5-фторурацил и его пероральная форма капецитабин) используются для лечения онкозаболеваний ЖКТ и некоторых других локализаций. Риск развития ишемии миокарда зависит от дозы, пути введения и схемы химиотерапии. Боль в груди и изменения ЭКГ чаще возникают в покое в дни введения химиопрепарата. Иногда проявления ишемии сохраняются после отмены препаратов. Проблема ишемии миокарда, индуцированной фторпиримидинами, может быть недооценена клинически. Последние исследования показали, что у 5-6% пациентов, получавших 5-ФУ, при стресс-тестах выявлялась безболевая ишемия миокарда. Также применение 5-ФУ может приводить к развитию острого ИМ. Пациентам, получающим эти препараты, следует регулярно выполнять ЭКГ. При выявлении признаков ишемии миокарда следует прерывать терапию.
Иммунная и таргетная химиотерапия
Препараты этих групп, воздействующие на сигнальные пути фактора роста эндотелия сосудов (VEGF), увеличивают риск коронарного тромбоза. Эти сигнальные пути важны для поддержания жизнеспособности клеток эндотелия, а ингибирование этих путей приводит к повреждению клеток эндотелия и их гибели. Риск тромбоза зависит от исходного заболевания и конкретного препарата. Так, для моноклонального антитела к рецептору VEGF бевацизумаба, риск составляет менее 1% при адьювантной терапии рака молочной железы, а при лечении метастатических форм онкозаболеваний – 3,8%.
Лучевая терапия
Наддиафрагмальная (а при некоторых заболеваниях и поддиафрагмальная) лучевая терапия ассоциируется с высоким риском развития ИБС как за счет агрессивного течения атеросклероза, так и за счет других процессов, приводящих к разрывам бляшек и тромбозу коронарных артерий, а также, возможно, и за счет коронарного спазма. Для атеросклероза, вызванного лучевой терапией, характерно устьевое поражение коронарных артерий. Чаще всего затрагиваются передняя нисходящая артерия (при облучении левой молочной железы) и ствол левой коронарной артерии (при лечении лимфомы Ходжкина). Есть данные, что у женщин, которым проводилась лучевая терапия по поводу рака левой молочной железы, частота положительных стресс -тестов достоверно выше, чем у получавших лечение по поводу рака правой молочной железы.
Манифестация ИБС может быть быстрой (первое проявление болезни – ОКС или внезапная смерть), но чаще эффект бывает отсроченным. Например, изменения после лечения лимфомы чаще манифестируют через 15-20 лет (причем, молодые пациенты более восприимчивы к такому воздействию). Пациенты, выжившие после лечения лимфомы Ходжкина, характеризуются риском ИБС в 4-7 раз большим, чем вся популяция. Через 40 лет после лечения у 50% пациентов диагностируется ИБС.
Исходя из этих данных, оправдано проводить регулярное скрининговое обследование всех пациентов, которым проводилась лучевая терапия соответствующей локализации, начиная с момента 10-15 лет после лечения и далее пожизненно.
Дополнительными факторами риска возникновения или осложнений ИБС в результате лучевой терапии являются сопутствующий прием антрациклинов, молодой возраст, высокие дозы облучения (>30 Грей), отсутствие экранирования грудной клетки, классические факторы риска сердечно-сосудистых заболеваний и предсуществующая ИБС.
Внезапная сердечная смерть – явление, описанное у пациентов, подвергавшихся облучению. Связано оно было с диффузной гиперплазией интимы всех коронарных артерий или с гемодинамически значимым поражением ствола ЛКА.
Для предотвращения поражения сердца должны быть использованы такие методы, как максимально возможное снижение дозы облучения, тангенциальные поля облучения, экранирование структур сердца. В настоящее время существуют технологии, основанные на 3D планировании полей облучения с построением гистограмм доза-объем, а также различные симмуляционные программы. С помощью результатов КТ или МРТ можно достаточно точно идентифицировать контуры опухоли, а специальные программы рассчитывают распределение облучения.
Особенности диагностики и лечения
Перед началом химиотерапии или лучевой терапии важно выявить ИБС или другие сердечно-сосудистые заболевания, поскольку их исходное наличие значительно повышает риск дальнейших осложнений лечения онкозаболеваний.
Часто на фоне химио- и лучевой терапии развивается тромбоцитопения, поэтому лечение симптомной ИБС и ОКС крайне затруднено. Вообще, применение антитромботической терапии у получающих химио- или лучевую терапию часто противопоказано или очень ограничено. Пациентам, которым выполняется ЧКВ, необходимо использовать двойную антитромбоцитарную терапию как можно меньше по времени для минимизации риска кровотечений.
Клиника ИБС часто носит атипичный характер, зачастую развивается безболевая ишемия миокарда (за счет нейротоксических эффектов лучевой и химиотерапии).
В случае развития вазоспазма на фоне химиотерапии следует сменить используемый препарат. Если иных вариантов нет, продолжать терапию следует на фоне профилактического введения нитратов и/или антагонистов кальция под тщательным контролем.
В случае развития любых осложнений химио- и лучевой терапии со стороны сердечно-сосудистой системы пациенты подлежат длительному наблюдению кардиологом.
Тромбоэмболические осложнения фибрилляции предсердий
Для оптимизации антитромботической профилактики у пациентов с ФП обычно используют шкалы CHA2DS2-VASc и HAS-BLED. Однако обе эти шкалы не валидизировались у пациентов с онкозаболеваниями. У пациентов с онкозаболеваниями повышен риск как тромбоэмболических осложнений, так и кровотечений. Поэтому принятие решения о назначении антитромботической терапии может быть достаточно сложным и отличаться от общей популяции. Пациентам со значением CHA2DS2-VASc≥2 антикоагулянты могут быть назначены при числе тромбоцитов более 50 тыс/мкл (как правило, речь идет об АВК при условии хорошего контроля МНО – время пребывания в терапевтическом диапазоне МНО > 70%). В случае формально низкого риска ТЭО в соответствии со значениями CHA2DS2-VASc антикоагулянты все равно могут быть назначены, принимая во внимание риск венозной тромбоэмболии.
НМГ назначают в качестве краткосрочного лечения, либо как альтернатива варфарину у пациентов с высоким риском кровотечений или метастатическим поражением.
Данные по НОАК пока относительно ограничены. Кроме того, в исследования этих препаратов не включались пациенты с уровнем тромбоцитов менее 100 тыс/мкл. Однако мета-анализ исследований НОАК показал, что эти препараты безопасны для пациентов с онкозаболеваниями.
Артериальные тромбозы
Артериальные тромбозы достаточно редки у пациентов с онкозаболеваниями (около 1%). Чаще они развиваются у пациентов с метастазирующим раком поджелудочной железы, молочной железы, колоректальным раком или раком легких, а также у пациентов, получающих антрациклины, таксаны, химиопрепараты на основе платины, а также ингибиторы VEGF. Чаще всего речь идет о пациентах с неблагоприятным прогнозом. Протромботический статус может увеличивать риск ТЭО у пациентов с ФП.
У пациентов с раком молочных желез, получающих гормональную терапию, риск артериальных тромбозов выше у использующих ингибиторы ароматаз по сравнению с тамоксифеном (по- видимому, за счет несколько более благоприятного влияния тамоксифена на липидный профиль).
Особенности лечения артериальных тромбозов у онкологических пациентов плохо изучены.
В случае повторных эпизодов артериальных тромбозов следует исключить наличие антител к фосфолипидам.
ВТЭО
Венозный тромбоз и тромбоэмболия развиваются у 20% госпитализированных больных с раком (причем часто эти осложнения остаются не диагностированными). Помимо собственного влияния онкозаболевания, риск ВТЭО может повышаться на фоне химиотерапии (в том числе, с учетом использования неудаляемых венозных катетеров). Антитромботическая профилактика должна проводиться минимум в течение 4 недель после оперативного лечения.
У амбулаторных пациентов с раком мочевого пузыря, толстой кишки, яичников, легких, желудка и поджелудочной железы, получающих химиотерапию, риск ВТЭО также повышен, но целесообразность медикаментозной профилактики у таких пациентов неясна.
Таблица 2. Факторы риска венозной тромбоэмболии у онкологических пациентов.

Химиотерапия в комбинации с ингибиторами VEGF повышает риск ВТЭО в 6 раз, повторных ВТЭО – в 2 раза.
Выявление тромботических эпизодов в первую очередь основывается на наличии соответствующих симптомов. Ни одна из стратегий скрининга тромботических осложнений себя не оправдала. Часто при визуализации очага поражения находками являются бессимптомные тромбозы и даже ТЭЛА. Оптимальная стратегия лечения в этом случае не ясна, однако с целью профилактики повторных эпизодов такие тромбозы лечат как обычные.
Для лечения подтвержденного острого эпизода ВТЭО у гемодинамически стабильных пациентов следует назначать НМГ на 3-6 месяцев (такая терапия эффективнее варфарина при сходной частоте кровотечений и смертности). Риск геморрагических осложнений на фоне антикоагулянтной терапии ВТЭО у онкологических пациентов в 6 раз выше в сравнении с обычными пациентами с ВТЭО.
Онкозаболевания значительно повышают риск повторных ВТЭО, поэтому после окончания периода первоначального лечения антикоагулянтами следует оценить возможность назначения антикоагулянтной профилактической терапии (до того момента, когда рак будет считаться «вылеченным»).
Данные по НОАК у этой категории больных ограничены анализом в подгруппах в исследованиях, сравнивающих НОАК и варфарин (не было получено данных о различиях по частоте повторных ВТЭО и кровотечений). С НМГ НОАК не сравнивались. Разные НОАК могут отличаться между собой в связи с лекарственными взаимодействиями и разной чувствительностью к почечной и печеночной дисфункции.
Если повторное ВТЭО произошло на фоне антикоагулянтов, следует изменить терапию (перейти с АВК на НМГ, если пациент уже получает НМГ – увеличить дозу).
На настоящий момент нет четких доказательств целесообразности проведения тромболизиса в случае развития ТЭЛА с гемодинамической нестабильностью у этой категории пациентов, что связано со значительно повышенным риском кровотечений. Однако в ряде случаев (ориентируясь на ожидаемую продолжительность жизни) тромболизис может быть выполнен, принимая во внимание высокую смертность от такого типа ТЭЛА. Важно помнить о противопоказаниях к тромболизису у пациентов с опухолями ГМ и метастазами в ГМ. Также может быть выполнена хирургическая эмболэктомия, однако смертность во время этого вмешательства достаточно высока, и кардиопульмональное шунтирование требует агрессивной антикоагуляции.
Что касается профилактики ВТЭО у пациентов на химиотерапии, в настоящее время рекомендовано проводить медикаментозную профилактику (преимущественно, НМГ) амбулаторным пациентам с высоким риском ВТЭО (например, получающим анти-ангиогенные препараты по поводу множественной миеломы, либо химиотерапию по поводу местнораспространенного или метастатического рака поджелудочной железы или легких), но без высокого риска кровотечений.
У пациентов с центральным венозным катетером показано использование гепарина или АВК (причем применение гепарина ассоциировано с большей частотой тромбоцитопении и бессимптомных тромбозов глубоких вен).
Атеросклероз периферических артерий и инсульт
Тяжелое атеросклеротическое и неатеросклеротическое поражение артерий нижних конечностей может развиться у пациентов (до 30%), получающих нилотиниб, понатиниб или ингибиторы тирозин-киназы BCR-ABL (например, для лечения миелоидного лейкоза). Поражение может развиться даже в отсутствие факторов риска АПАНК, а в присутствии таких факторов риск поражения артерий нижних конечностей еще увеличивается. Поражение может развиться как в первый месяц терапии, так и отсрочено, в том числе – годы спустя после лечения. Ряд химиопрепаратов (например, L-аспарагиназа, цисплатин, метотрексат, 5-фторурацил и паклитаксел) может вызывать феномен Рейно.
Риск инсульта повышается (по меньшей мере, вдвое) после лучевой терапии на область средостения, шеи или головы. Происходит повреждение и тромбоз малых сосудов головного мозга. В сосудах среднего и крупного калибра описаны три патофизиологических механизма, повышающих риск инсульта – окклюзия vasa vasorum с последующим медианекрозом и фиброзом, фиброз адвентиции, а также прогрессирование атеросклероза (чаще развивается более чес через 10 лет после лучевой терапии). Похожие механизмы повреждения описаны для аорты и других периферических сосудов (включая подключичные и подвздошно-бедренные артерии, что приводит к ишемии конечностей).
Пациентам, которым проводилась лучевая терапия на область шеи или головы, а также лечение лимфомы, должно выполняться ультразвуковое исследование церебральных сосудов (особенно начиная с периода 5 лет после лучевой терапии). Исследование должно повторяться каждые 5 лет (или чаще, если при первом исследовании были обнаружены отклонения). Признаки постлучевых поражений других артерий выявляют при физикальном осмотре или по наличию соответствующих симптомов.
По материалам:
Jose Luis Zamorano, Patrizio Lancellotti, Daniel Rodriguez Muñoz, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. European Heart Journal (2016) 37, 2768–2801.
https://eurheartj.oxfordjournals.org/content/ehj/37/36/2768.full.pdf
Материал подготовлен сотрудником лаборатории клинических проблем атеротромбоза отдела ангиологии РКНПК им. А.Л. Мясникова к.м.н. Шахматовой О.О.
Источник
