Ишемические болезни сердца инфаркт миокарда
Содержание:
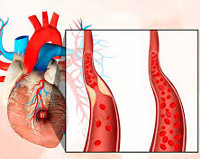
Инфаркт миокарда (ИМ) – самая серьезная клиническая форма ишемии сердца. Это острое, угрожающее жизни, состояние, обусловленное относительным либо абсолютным недостатком кровоснабжения определенной части миокарда вследствие тромбоза коронарной артерии, в результате чего формируется очаг некроза, т.е. область с отмершими клетками – кардиомиоцитами.
Инфаркт сердца – одна из ведущих причин смертности населения планеты. Его развитие напрямую зависит от возраста и пола человека. В связи с более поздним появлением атеросклероза у женщин инфаркты диагностируются у них в 3–5 раз реже, чем у мужчин. В группу риска попадают все представители мужского пола, начиная с 40-летнего возраста. У людей обоих полов, перешедших рубеж 55–65 лет, заболеваемость примерно одинакова. По статистике 30–35% всех случаев острого инфаркта сердечной мышцы заканчиваются летальным исходом. До 20% внезапных смертей вызваны этой патологией.
Причины инфаркта
Главные причины развития ИМ:
- Атеросклероз сосудов сердца, в частности коронарных артерий. В 97% случаев атеросклеротическое поражение стенок сосудов приводит к развитию ишемии миокарда с критическим сужением просвета артерий и длительным нарушением кровоснабжения миокарда.
- Тромбоз сосудов, к примеру, при коронарите различного генеза.Полное прекращение кровоснабжениямышцы происходит вследствиеобтурации (закупорки) артерий или мелких сосудов атеросклеротической бляшкой или тромбом.
- Эмболия венечных артерий, например, при септическом эндокардите, реже заканчивается образованием некротического очага, тем не менее являясь одной из причин формирования острой ишемии миокарда.
Нередко встречается сочетание вышеперечисленных факторов: тромб закупоривает спастически суженный просвет артерии, пораженной атеросклерозом или формируется в области атеросклеротической бляшки, выпяченной из-за произошедшего кровоизлияния в ее основание.
- Пороки сердца. Коронарные артерии могут отходит от аорты вследствие формирования органического поражения сердца.
- Хирургическая обтурация. Механическое вскрытие артерии или ее перевязка во время проведения ангиопластики.
Факторы риска инфаркта миокарда:
- Пол (у мужчин чаще).
- Возраст (после 40–65 лет).
- Стенокардия.
- Порок сердца.
- Ожирение.
- Сильный стресс или физическое перенапряжение при имеющейся ИБС и атеросклерозе.
- Сахарный диабет.
- Дислипопротеинемия, чаще гиперлипопротеинемия.
- Курение и прием алкоголя.
- Гиподинамия.
- Артериальная гипертония.
- Ревмокардит, эндокардит или другие воспалительные поражения сердца.
- Аномалии развития коронарных сосудов.
Механизм развития инфаркта миокарда
Течение болезни делится на 5 периодов:
- Прединфарктный (стенокардия).
- Острейший (острая ишемия сосудов сердца).
- Острый (некробиоз с формированием некротической области).
- Подострый (стадия организации).
- Постинфарктный (образование рубца в месте некроза).
Последовательность патогенетических изменений:
- Нарушение целостности атеросклеротического отложения.
- Тромбоз сосуда.
- Рефлекторный спазм поврежденного сосуда.
При атеросклерозе избыточный холестерин откладывается на стенках сосудов сердца, на которых образуются липидные бляшки. Они сужают просвет пораженного сосуда, замедляя кровоток по нему. Различные провоцирующие факторы, будь то гипертонический криз или эмоциональное перенапряжение, приводят к разрыву атеросклеротического отложения и повреждению сосудистой стенки. Нарушение целостности внутреннего слоя артерии активирует защитный механизм в виде свертывающей системы организма. К месту разрыва прилипают тромбоциты, из которых формируется тромб, закупоривающий просвет сосуда. Тромбоз сопровождается выработкой веществ, приводящих к спазмированию сосуда в области повреждения либо по всей его длине.
Клиническое значение имеет сужение артерии на 70% размера ее диаметра, при этом просвет спазмируется до такой степени, что кровоснабжение не может быть компенсировано. Это возникает вследствие атеросклеротических отложений на стенки сосудов и ангиоспазма. В результате нарушается гемодинамика области мышцы, получающей кровь через поврежденное сосудистое русло. При некробиозе страдают кардиомиоциты, недополучая кислород и питательные вещества. Нарушается метаболизм и функционирование сердечной мышцы, ее клетки начинают отмирать. Период некробиоза длится до 7 часов. При незамедлительно оказанной в этот промежуток времени медицинской помощи происходящие изменения в мышце могут быть обратимы.
При формировании некроза в пораженной области восстановить клетки и повернуть процесс вспять невозможно, повреждения приобретают необратимый характер. Страдает сократительная функция миокарда, т.к. некротизированная ткань не участвует в сокращении сердца. Чем обширнее область поражения, тем сильнее снижается сократимость миокарда.
Единичные кардиомиоциты или небольшие их группы гибнут спустя примерно 12 часов от начала острого заболевания. Через сутки микроскопически подтверждается массовое омертвление клеток сердца в зоне поражения. Замещение области некроза соединительной тканью начинается через 7–14 дней от начала инфаркта. Постинфарктный период продолжается 1,5–2 месяца, в течение которых окончательно формируется рубец.
Передняя стенка левого желудочка – наиболее частое место локализации некротической зоны, поэтому в большинстве случаев выявляется трансмуральный ИМ именно этой стенки. Реже поражается верхушечная область, задняя стенка или межжелудочковая перегородка. Инфаркты правого желудочка в кардиологической практике встречаются редко.
Классификация инфаркта миокарда
Относительно размера поражения ткани инфаркт миокарда бывает:
- Мелкоочаговый. Формируется один или несколько маленьких по размеру некротических участков. Диагностируется в 20% случаев от общего числа инфарктников. У 30% пациентов мелкоочаговый инфаркт трансформируется в крупноочаговый.
- Крупноочаговый (чаще трансмуральный). Образуется обширная область некроза.
По глубине некротического поражения различают:
- Трансмуральный. Некротическая область охватывает всю толщу миокарда.
- Субэпикардиальный. Участок с отмершими кардиомиоцитами прилегает к эпикарду.
- Субэндокардиальный. Некроз сердечной мышца в районе прилегания к эндокарду.
- Интрамуральный. Участок некроза находится в толще левого желудочка, но не доходит до эпикарда или эндокарда.
В зависимости от кратности возникновения:
- Первичный. Возникает первый раз.
- Повторный. Развивается через 2 месяца или позже после начала первичного.
- Рецидивирующий. Появляется на стадии формирования рубцовой ткани первичного инфаркта, т.е. в течение первых 2 мес. от первичного острого поражения миокарда.
Относительно локализации процесса:
- Левожелудочковый.
- Правожелудочковый.
- Септальный, или инфаркт межжелудочковой перегородки.
- Сочетанный, к примеру переднебоковой ИМ.
Отталкиваясь от электрокардиологических изменений, фиксируемых на кардиограмме:
- Q-инфаркт. Электрокардиограмма фиксирует сформировавшийся патологический з. Q или желудочковый комплекс QS. Изменения характерны для крупноочаговых ИМ.
- Не Q-инфаркт с инверсией з. Т и без патологии з. Q. Чаще встречается при мелкоочаговых инфарктах.
В зависимости от развития осложнений:
- Неосложненный.
- Осложненный.
Формы острого ИМ, относительно наличия и места расположения болей:
- Типичная. Боль сосредоточена в прекардиальной либо загрудинной области.
- Атипичная. Форма заболевания с атипичной локализацией болей:
Периоды заболевания:
- Острейший.
- Острый.
- Подострый.
- Постинфарктный.
Симптомы инфаркта миокарда
Интенсивность и характер болевых ощущений зависят от нескольких факторов: размера и локализации некротического очага, а также стадии и формы инфаркта. У каждого пациента клинические проявления различны в силу индивидуальных особенностей и состояния сосудистой системы.
Признаки типичной формы инфаркта миокарда
Яркая клиническая картина с типичным и выраженным болевым синдромом наблюдается при крупноочаговом (трансмуральном) инфаркте сердца. Течение болезни разделяю на определенные периоды:
- Прединфарктный, или продромальный период. У 43–45% инфарктников этот период отсутствует, т.к. болезнь начинается внезапно. Большинство пациентов перед инфарктом отмечают учащение приступов стенокардии, загрудинные боли становятся интенсивными и продолжительными. Изменяется общее состояние – снижается настроение, появляется разбитость и страх. Эффективность антиангинальных средств значительно снижается.
- Острейший период (от 30 мин до нескольких часов). При типичной форме острый инфаркт сопровождается нестерпимой загрудинной болью с иррадиацией в левую сторону туловища – руку, нижнюю челюсть, ключицу, предплечье, плечо, область между лопатками. Редко под лопатку или левое бедро. Боли могут быть жгучими, режущими, давящими. Некоторые ощущают распирание в груди или ломоту. В течение нескольких минут боль достигает своего максимума, после чего сохраняется до часа и дольше, то усиливаясь, то ослабевая.
- Острый период (до 2 суток, при рецидивирующем течении до 10 дней и дольше). У подавляющего большинства больных ангинозная боль проходит. Ее сохранение свидетельствует о присоединении эпистеноперикардиального перикардита либо о продолжительном течении ИМ. Нарушения проводимости и ритма сохраняются, также как и артериальная гипотензия.
- Подострый период (длительность – 1 мес). Общее состояние пациентов улучшается: температура нормализуется, проходит одышка. Полностью или частично восстанавливается сердечный ритм, проводимость, звучность тонов, но блокада сердца регрессу не поддается.
- Постинфарктный период – завершающий этап течения острого ИМ, длящийся до 6 месяцев. Некротическая ткань окончательно заменяется плотным рубцом. Сердечная недостаточность устраняется за счет компенсаторной гипертрофии сохранившегося миокарда, но при обширной площади поражения полная компенсация невозможна. В этом случае проявления сердечной недостаточности прогрессируют.
Начало боли сопровождается сильной слабостью, появлением обильного липкого (профузного) пота, чувством страха смерти, учащением сердцебиения. При физикальном обследовании выявляется бледность кожи, липкий пот, тахикардия и другие нарушения ритма (экстрасистолия, фибрилляция предсердий), возбуждение, одышка в покое. В первые минуты повышается артериальное давление, потом резко понижается, что свидетельствует о развивающейся недостаточности сердца и кардиогенном шоке.
При тяжелом течении развивается отек легких, иногда сердечная астма. Тоны сердца при аускультации приглушены. Появление ритма галопа говорит о левожелудочковой недостаточности, от степени выраженности которой зависит аускультативная картина легких. Жесткое дыхание, хрипы (влажные) подтверждают застой крови в легких.
Ангинозная боль в этом периоде нитратами не купируется.
В результате перифокального воспаления и некроза появляется лихорадка, сохраняющаяся на протяжении всего периода. Температура поднимается до 38,50 С, высота ее подъема зависит от размера некротического очага.
При мелкоочаговом инфаркте мышцы сердца симптоматика менее выражена, течение болезни не такое четкое. Редко развивается недостаточность сердца. Аритмия выражается в умеренной тахикардии, которая бывает не у всех больных.
Признаки атипичных форм инфаркта миокарда
Подобные формы характеризуются нетипичной локализацией болей, затрудняющей своевременную установку диагноза.
- Астматическая форма. Характерен кашель, приступы удушья, проливной холодный пот.
- Гастралгическая (абдоминальная) форма проявляется болями в эпигастральной области, рвотой, тошнотой.
- Отечная форма бывает при массивной очаге некроза, приводящем к тотальной сердечной недостаточности с отеками, одышкой.
- Церебральная форма характерна для пожилых пациентов с выраженным атеросклерозом не только сердечных, но и мозговых сосудов. Проявляется клиникой ишемии головного мозга с головокружениями, потерей сознания, шумом в ушах.
- Аритмическая форма. Единственным ее признаком может быть пароксизмальная тахикардия.
- Стертая форма отличается отсутствием жалоб.
- Периферическая форма. Боли могут быть только в руке, подвздошной ямке, нижней челюсти, под лопаткой. Иногда опоясывающая боль схожа с болями, возникающими при межреберной невралгии.
Осложнения и последствия инфаркта миокарда
- Тромбоз в желудочках.
- Острый эрозивный гастрит.
- Острый панкреатит либо колит.
- Парез кишечника.
- Желудочное кровотечение.
- Синдром Дресслера.
- Острая, а в дальнейшем хроническая прогрессирующая недостаточность сердца.
- Кардиогенный шок.
- Постинфарктный синдром.
- Эпистенокардиальный перикардит.
- Тромбоэмболии.
- Аневризма сердца.
- Отек легких.
- Разрыв сердца, приводящий к его тампонаде.
- Аритмии: пароксизмальная тахикардия, экстрасистолия, внутрижелудочковая блокада, фибрилляция желудочков и другие.
- Инфаркт легких.
- Пристеночный тромбоэндокардит.
- Психические и нервные расстройства.
Диагностика инфаркта миокарда
Анамнез болезни, электрокардиографические признаки (изменения на ЭКГ) и характерные сдвиги ферментативной активности в сыворотке крови являются основным критериями при диагностике острого ИМ.
Лабораторная диагностика
В первые 6 часов острого состояния в крови выявляется повышенный уровень белка – миоглобина, участвующего в транспортировке кислорода внутрь кардиомиоцитов. В течение 8–10 часов больше чем на 50% увеличивается креатинфосфокиназа, показатели активности которой нормализуются к концу 2 суток. Этот анализ повторяют каждые 8 часов. Если получают троекратный отрицательный результат, то инфаркт сердца не подтверждается.
На более позднем сроке необходим анализ на определение уровня лактатдегидрогеназы (ЛДГ). Активность этого фермента увеличивается спустя 1–2 суток от начала массового омертвления кардиомиоцитов, по прошествии 1–2 недель приходит в норму. Высокой специфичностью отличается повышение изоформ тропонина, увеличение уровня аминотрансфераз (АСТ, АЛТ). В общем анализе – повышение СОЭ, лейкоцитоз.
Инструментальная диагностика
ЭКГ фиксирует появление отрицательного з. Т либо его двухфазность в определенных отведениях (при мелкоочаговом ИМ), патологии комплекса QRS или з. Q (при крупноочаговом ИМ), а также различные нарушения проводимости, аритмии.
Электрокардиография помогает определить обширность и локализацию области омертвения, оценить сократительную способность сердечной мышцы, выявить осложнения. Рентгенологическое исследование малоинформативно. На поздних этапах проводят коронарографию, выявляющую место, степень сужения или непроходимости коронарной артерии.
Лечение инфаркта миокарда
При подозрении на инфаркт сердца срочно вызывают скорую помощь. До приезда медиков нужно помочь больному принять полусидячее положение с согнутыми в коленях ногами, ослабить галстук, расстегнуть одежду, чтобы она не стягивала грудь и шею. Открыть форточку или окно для доступа свежего воздуха. Под язык положить таблетку аспирина и нитроглицерина, которые предварительно измельчить или попросить больного их разжевать. Это необходимо для более быстрого всасывания действующего вещества и получения скорейшего эффекта. Если ангинозные боли не прошли от одной таблетки нитроглицерина, то его следует рассасывать через каждые 5 минут, но не больше 3 таблеток.
Больной с подозрением на инфаркт сердца подлежит незамедлительной госпитализации в кардиологическую реанимацию. Чем раньше реаниматологи начнут лечение, тем благоприятнее дальнейший прогноз: можно предупредить развитие ИМ, предотвратить появление осложнений, сократить площадь очага некроза.
Основные цели первоочередных лечебных мероприятий:
- снятие болевого синдрома;
- ограничение некротической зоны;
- предотвращение осложнений.
Купирование болевых ощущений – один из важнейших и неотложных этапов лечения ИМ. При неэффективности таблетированного нитроглицерина, его вводят в/в капельно либо наркотический анальгетик (например, морфин) + атропин в/в. В некоторых случаях проводят нейролептанальгезию – в/в нейролептик (дроперидол) + анальгетик (фентанил).
Тромболитическая и антикоагулянтная терапия направлена на сокращение зоны некроза. Впервые сутки от появления первых признаков инфаркта для рассасывания тромба и восстановления кровотока возможно проведение процедуры тромболизиса, но для предотвращения гибели кардиомиоцитов эффективнее ее делать в первые 1–3 часа. Назначают тромболитические препараты – фибринолитики (стрептокиназа, стрептаза), антиагреганты (тромбо-АСС), антикоагулянты (гепарин, варфарин).
Антиаритмическая терапия. Для устранения нарушений ритма, сердечной недостаточности, восстановления метаболизма в ткани сердца применяют антиаритмические препараты (бисопролол, лидокаин, верапамил, атенолол), анаболики (ретаболил), поляризующую смесь и т.д.
Для лечения острой недостаточности сердца используют сердечные гликозиды (коргликон, строфантин), диуретики (фуросемид).
Для устранения психомоторного возбуждения применяют нейролептики, транквилизаторы (седуксен), седативные средства.
Прогноз заболевания зависит от быстроты оказания первой квалифицированной помощи, своевременности проведения реанимационных мероприятий, размера и локализации очага поражения миокарда, наличия либо отсутствия осложнений, возраста пациента и имеющихся у него сопутствующих сердечно-сосудистых патологий.
Источник
Безболевая ишемия миокарда – особая форма ишемической болезни сердца с объективно выявляемыми признаками недостаточности кровоснабжения сердечной мышцы, не проявляющимися болью. Заболевание не сопровождается типичными для ИБС симптомами ‒ одышкой, аритмией, болевым синдромом. В это же время, объективные методы исследования (электрокардиография, холтеровское мониторирование, коронарография) фиксируют характерные для стенокардии изменения миокарда. Несмотря на бессимптомность, «немая» ишемия имеет неблагоприятные прогнозы и требует своевременного лечения ‒ коррекции образа жизни, медикаментозной терапии, а подчас кардиохирургического вмешательства.
Общие сведения
Безболевая ишемия миокарда (ББИМ) ‒ один из вариантов ИБС, при котором имеются объективные данные ишемии миокарда, но отсутствуют ее клинические проявления. Наблюдается как у страдающих различными формами ишемической болезни, так и у лиц без диагностированных ранее коронарных патологий. Распространенность заболевания составляет 2-5% среди всего населения, 12-25% среди больных с факторами риска ИБС: отягощенной наследственностью, эссенциальной гипертензией, ожирением, вредными привычками, гиподинамией, сахарным диабетом. Признаки ББИМ выявляются на ЭКГ у каждого 8-го обследуемого старше 55 лет.

Безболевая ишемия миокарда
Причины
Эпизоды «немой» ишемии, как и типичные болевые приступы стенокардии, возникают под влиянием самых различных факторов: физической нагрузки, стресса, курения, холода, высокой температуры, приема алкоголя в больших количествах или высоких доз кофеина. При этом патофизиологическими причинами, лежащими в основе ББИМ и возникающими от воздействия вышеназванных факторов, являются:
- Стеноз коронарных сосудов. В большинстве случаев вызван атеросклеротическим поражением артерий сердца. С разной степенью выраженности это состояние диагностируется более чем у половины больных с эпизодами «немой» ишемии. Клинически важным считается уменьшение просвета венечных артерий на 30-70%. Кроме атеросклероза, стеноз может быть обусловлен системными васкулитами, опухолевыми процессами.
- Ангиоспазм венечных артерий. Возникает из-за снижения продукции эндотелием сосудов веществ с вазодилатирующими свойствами (NO, простациклины), увеличения выброса субстанций с вазоконстрикторными свойствами (ангиотензин 2, эндотелин, серотонин, тромбоксан 2А) и повышения активности симпато-адреналовой системы из-за стресса, нагрузки.
- Атеротромбоз коронарных артерий. Чаще всего вызван изъязвлением атеросклеротических бляшек в сосудах, попаданием тромба с кровотоком из других участков кровеносной системы, нарушением свертывающей функции тромбоцитов. Тромб может перекрывать просвет сосуда частично или полностью. В первом случае возникают эпизоды болевой или безболевой ишемии, во втором – безболевой инфаркт миокарда.
Существуют определенные группы риска, среди которых вероятность развития ББИМ особенно высока. Это лица, перенесшие инфаркт; пациенты, имеющие несколько факторов угрозы развития ИБС; больные с ИБС, сочетающейся с гипертонией или хроническими обструктивными болезнями легких. К этой же категории относятся представители профессий с высоким уровнем стресса: пилоты, авиадиспетчеры, водители, хирурги и т. д.
Патогенез
В основе безболевой ишемии лежит несоответствие между потребностью миокарда в кислороде и фактической перфузией сердечной мышцы. Под воздействием тех или иных причин (эмоциональное перенапряжение, физическая нагрузка и др.) кардиомиоциты начинают ощущать кислородное голодание и компенсаторно переходят на бескислородный тип синтеза энергии ‒ анаэробный гликолиз. Такой вид метаболизма глюкозы приводит к скорому энергетическому истощению клеток, накоплению соединений, в норме раздражающих нервные окончания, которые участвуют в формировании ощущения боли в коре головного мозга. При ББИМ это ощущение не возникает. Существует несколько патогенетических гипотез, однако ни одна из них до конца не объясняет механизм развития безболевых приступов.
Безболезненность эпизодов ишемии связывают со сниженной чувствительностью интракардиальных нервных окончаний вследствие диабетической нейропатии, частичной гибели нейронов при инфаркте, действия лекарственных препаратов, токсинов. Парадокс заключается в том, что безболевая ишемия встречается и у относительно здоровых лиц, не имеющих в анамнезе факторов, достоверно способных нарушить проводимость нервных волокон сердца (не имеющих инфаркта, других сердечно-сосудистых событий, диабета, хронических или острых интоксикаций).
Отсутствие болей также связывают с недостаточностью силы и длительности ишемии миокарда. Экспериментально доказано, что ишемия вызывает болевые ощущения лишь при достижении определенных пороговых значений ‒ при длительности не менее 3-х минут. Однако известно и о случаях возникновения ангинозной боли при минимальных проявлениях ишемии и, напротив, отсутствии каких-либо симптомов при обширных длительных нарушениях перфузии сердечной мышцы.
«Немую» ишемию также объясняют сбоем формирования болевых ощущений в связи с уменьшением количества внутримышечных рецепторов к аденозину (основной активатор болевых рецепторов, выделяющийся при кардиальной ишемии) или снижением чувствительности к нему этих самых рецепторов. Тем не менее, невозможно достоверно точно установить, как изменяется число рецепторов от начала болезни до момента обращения пациента за помощью. Непонятно также, почему при одинаковой концентрации аденозина в одних случаях ишемия «немая», а в других сопровождается болью.
Отсутствие боли связывают и с повышением активности антиболевой системы, имеющей нервно-гуморальный механизм регуляции. Уменьшение болевых ощущений из-за активации нервного компонента реализуется усилением активности ретикулярной формации и таламуса в головном мозге. Гуморальный компонент проявляется увеличением в плазме концентрации естественных опиоидов ‒ эндорфинов, снижающих восприимчивость к боли. Установлено, что больные с ББИМ имеют более высокий уровень эндорфинов в плазме крови как после физических нагрузок, так и в покое, чем пациенты с клиническими проявлениями ишемии.
Классификация
С целью правильной оценки тяжести состояния пациента на момент обращения или обследования и отслеживания динамики заболевания в кардиологии используется предложенная в 1985 г. классификация патологии, основанная на данных анамнеза, клинической картине, эпизодах ишемии. Согласно ей выделяют три типа безболевой ишемии:
- Тип I. ББИМ среди пациентов с доказанным посредством коронароангиографии гемодинамически явным стенозом сердечных артерий. У больных нет приступов стенокардии, инфаркта миокарда в прошлом. Отсутствуют патологии ритма сердца, нет застойной сердечной недостаточности.
- Тип II. Ишемия без сопутствующей стенокардии, но с инфарктом миокарда в истории болезни пациента.
- Тип III. «Тихая» ишемия у больных ИБС со стенокардией, вазоспазмом. За сутки эти больные имеют случаи болевых и безболевых приступов ишемии.
В практической деятельности широко используется классификация, включающая 2 типа болезни: 1-й тип – ББИМ без явных симптомов, свойственных ишемии миокарда, 2-й – «немая» ишемия в сочетании с болевыми эпизодами стенокардии, другими формами ИБС.
Симптомы безболевой ишемии миокарда
Коварство безболевой ишемии заключается в абсолютной безболезненности ее эпизодов. Существует всего два показателя, по которым больной или врач может заподозрить наличие патологии: диагностированная стенокардия, ИБС или ИМ в анамнезе и прямое обнаружение ББИМ при профилактическом исследовании функции сердца с фиксацией характерных изменений на кардиограмме. В 70% случаев можно говорить о существовании безболевой ишемии у больных, перенесших инфаркт или имеющих ИБС. Практически все такие больные имеют 4 безболевых приступа на каждый приступ, сопровождающийся болью.
Осложнения
Наличие у пациента ББИМ ‒ неблагоприятный признак, говорящий о высоком риске развития осложнений. У таких больных частота внезапной сердечной смерти в 3 раза выше, чем у лиц с болевыми приступами ишемии. Инфаркт миокарда при безболевой ишемии имеет менее выраженные, неявные симптомы, интенсивности которых недостаточно, чтобы насторожить больного, заставив предпринять необходимые меры предосторожности: прекратить или снизить физическую нагрузку, принять медикаменты, обратиться за помощью. Явные клинические признаки в этом случае появляются уже тогда, когда наступило обширное поражение миокарда, и вероятность летального исхода выросла в разы.
Диагностика
Ввиду безболезненности течения ББИМ, в основе ее диагностики лежат инструментальные методы исследования, способные дать объективную информацию о наличии и степени ишемии сердечной мышцы. Наиболее значимыми маркерами такой ишемии считаются не имеющие клинических проявлений, но регистрируемые аппаратурой, изменения работы сердца. Также предположить наличие безболевой ишемии можно при оценке кровоснабжения миокарда. Эти и другие данные получают при помощи следующих методов диагностики:
- ЭКГ в покое. Один из самых распространенных, простых в исполнении и доступных методов диагностики. Позволяет получать информацию о характерных для ишемии миокарда изменениях в работе сердца. Недостатком ЭКГ является возможность регистрации данных лишь в состоянии физического покоя, тогда как безболевые приступы иногда могут проявляться лишь во время нагрузки.
- Холтеровское ЭКГ-мониторирование. Более информативно, чем рутинная ЭКГ. Дает значительно более полную информацию, так как проводится в естественной, привычной для пациента повседневной деятельности. Выявляет количество эпизодов ББИМ, определяет их продолжительность, зависимость от физической и эмоциональной активности в течение суток.
- Велоэргометрия. Суть метода ‒ в регистрации ЭКГ и уровня АД при дозированном увеличении физической нагрузки. При этом из-за нарастающей ЧСС возрастают потребности миокарда в кислороде. При безболевой ишемии увеличение кровоснабжения невозможно из-за патологии венечных сосудов, а значит, сердечная мышца начинает страдать от ишемии, что фиксируется с помощью электрокардиографии.
- Коронарография (КАГ). Считается одним из основных методов диагностики ББИМ из-за наличия доказанной прямой связи между заболеванием и стенозом коронарных артерий. Метод позволяет определить природу и степень сужения артерий сердца, установить, сколько и какие именно сосуды поражены, какова протяженность стеноза. Данные КАГ в значительной мере влияют на выбор метода лечения.
- Стресс-ЭХОКГ. В норме сердце сокращается ритмично, его мышечные волокна работают слаженно. Эта ритмичность и слаженность сохраняется даже при физической нагрузке, когда ЧСС увеличивается. Во время физической работы гипоперфузионный участок миокарда начинает работать асинхронно с остальной частью сердечной мышцы. Эти нарушения синергии сокращения фиксируются во время проведения стресс-ЭхоКГ.
- ОФЭКТ миокарда. Однофотонная эмиссионная компьютерная томография позволяет оценивать характер кровоснабжения миокарда на уровне микроциркуляторного русла, определять степень повреждения миоцитов, дает возможность отличить рубцовые изменения миокарда от ишемических. С помощью ОФЭКТ можно определить, насколько сильно сужение венечных артерий нарушает кровоснабжение и сократительную функцию миокарда.
- ПЭТ-КТ сердца. Дает возможность оценить площадь и глубину нарушения кровоснабжения миокарда. Преимущество ПЭТ ‒ в способности фиксировать мельчайшие изменения функции эндотелия, характерные для скрытого развития атеросклеротических бляшек, склонных к распаду. Таким образом, становится возможным раннее обнаружение коронарного атеросклероза и принятие превентивных мер по его лечению.
Лечение безболевой ишемии миокарда
Алгоритмы лечения ББИМ соответствуют таковым при других формах ИБС. Цель терапии ‒ устранение этиологических и патогенетических основ заболевания. Начинают лечение с исключения факторов риска – курения, гиподинамии, нерациональной диеты с большим количеством животных жиров, соли, красного мяса, алкоголя. Особую роль играет коррекция нарушений липидного и углеводного обмена, контроль АД, поддержание удовлетворительной гликемии при сахарном диабете. Медикаментозное лечение направлено на поддержку деятельности миокарда, увеличение его функциональной полноценности, нормализацию ритма. Предусматривает использование:
- β-адреноблокаторов (БАБ). Обладают способностью понижать ЧСС, оказывают выраженное антиангинальное действие, улучшают переносимость миокардом физических нагрузок. БАБ доказано снижают продолжительность и частоту болевых и безболевой эпизодов ишемии сердечной мышц. Благодаря выраженному антиаритмическому эффекту улучшают прогноз жизни.
- Антагонистов кальция (АК). Уменьшают ЧСС, расширяют коронарные и периферические артерии, нормализуют ритм сердца. За счет способности угнетать процессы метаболизма в кардиомиоцитах снижают их кислородные потребности и повышают толерантность к любым физическим нагрузкам. Менее эффективно предупреждают появление эпизодов заболевания в сравнении с БАБ.
- Нитратов. Уменьшают сопротивление в коронарных артериях, стимулируют коллатеральный кровоток, перераспределяют его в сторону ишемизированных участков миокарда, увеличивают количество активных коллатералей, межартериальных анастомозов. Расширяют просвет венечных сосудов в местах атеросклеротического поражения, проявляя кардиопротекторный эффект.
- Нитратоподобных вазодилататоров. Основной их эффект – стимуляция высвобождения эндотелиоцитами периферических и венечных артерий мощного сосудорасширяющего фактора – оксида азота. Благодаря ему улучшается кровоснабжение миокарда, снижается потребность миоцитов сердца в кислороде. Не устраняют причины безболевой ишемии, но снижают частоту ее эпизодов.
- Статинов. Действуют на одно из важнейших звеньев в патогенезе безболевой ишемии – на атеросклеротический процесс. Эффективно снижают уровень липопротеинов низкой плотности (ЛПНП) в крови, чем предотвращают формирование атеросклеротических бляшек на стенках венечных артерий, препятствуют сужению их просвета и нарушению перфузии мышцы сердца.
- Ингибиторов АПФ. Проявляют кардио- и вазопротекторные свойства. Кардиопротекция выражается в восстановлении и поддержании баланса между потребностями миокарда в кислороде и его обеспечением. В отношении сосудов оказывают антиатеросклеротическое действие, нормализуют функцию эндотелия, чем способствуют поддержанию тонуса и эластичности стенок артерий.
- Антитромбоцитарных препаратов. Снижают свертывающие способности тромбоцитов и уменьшают тромбообразование в участках поврежденных коронарных артерий. Показаны, в первую очередь, больным с безболевой ишемией и перенесенным инфарктом миокарда. Достоверно снижают риск повторных коронарных событий, в особенности, внезапной коронарной смерти.
Хирургическое лечение подразумевает восстановление нормальной или близкой к нормальной перфузии миокарда. Осуществляется путем проведения АКШ или стентирования коронарных артерий. Выбор метода зависит от исходного состояния больного, протяженности и степени поражения сердечных артерий, сопутствующих заболеваний, площади ишемизированного участка миокарда и др. Частота повторных приступов безболевой ишемии после операций составляет 33%, а вероятность летальных исходов снижается на 25%.
Прогноз и профилактика
Прогноз заболевания без подобающего лечения неблагоприятный. Около половины пациентов, имеющих стабильное течение ИБС и приступы безболевой ишемии, переносят коронарные события (нелетальный инфаркт, смерть, приступы стенокардии, требующие госпитализации) в течение 2,5 лет после постановки диагноза. Среди ранее перенесших инфаркт больных с ББИМ летальность составляет 20%. Ежегодное прохождение контрольных обследований у кардиолога, особенно после 50 лет (в том числе пациентами, не имеющими признаков ИБС), своевременное обнаружение ишемических эпизодов и терапия снижают частоту сердечных катастроф при ББИМ и летальность после их наступления.
Источник
