Ишемическая болезнь сердца инфаркт сердца
Содержание:
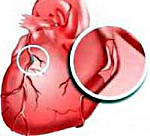
Инфаркт миокарда (ИМ) – самая серьезная клиническая форма ишемии сердца. Это острое, угрожающее жизни, состояние, обусловленное относительным либо абсолютным недостатком кровоснабжения определенной части миокарда вследствие тромбоза коронарной артерии, в результате чего формируется очаг некроза, т.е. область с отмершими клетками – кардиомиоцитами.
Инфаркт сердца – одна из ведущих причин смертности населения планеты. Его развитие напрямую зависит от возраста и пола человека. В связи с более поздним появлением атеросклероза у женщин инфаркты диагностируются у них в 3–5 раз реже, чем у мужчин. В группу риска попадают все представители мужского пола, начиная с 40-летнего возраста. У людей обоих полов, перешедших рубеж 55–65 лет, заболеваемость примерно одинакова. По статистике 30–35% всех случаев острого инфаркта сердечной мышцы заканчиваются летальным исходом. До 20% внезапных смертей вызваны этой патологией.
Причины инфаркта
Главные причины развития ИМ:
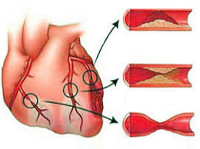
- Атеросклероз сосудов сердца, в частности коронарных артерий. В 97% случаев атеросклеротическое поражение стенок сосудов приводит к развитию ишемии миокарда с критическим сужением просвета артерий и длительным нарушением кровоснабжения миокарда.
- Тромбоз сосудов, к примеру, при коронарите различного генеза.Полное прекращение кровоснабжениямышцы происходит вследствиеобтурации (закупорки) артерий или мелких сосудов атеросклеротической бляшкой или тромбом.
- Эмболия венечных артерий, например, при септическом эндокардите, реже заканчивается образованием некротического очага, тем не менее являясь одной из причин формирования острой ишемии миокарда.
Нередко встречается сочетание вышеперечисленных факторов: тромб закупоривает спастически суженный просвет артерии, пораженной атеросклерозом или формируется в области атеросклеротической бляшки, выпяченной из-за произошедшего кровоизлияния в ее основание.
- Пороки сердца. Коронарные артерии могут отходит от аорты вследствие формирования органического поражения сердца.
- Хирургическая обтурация. Механическое вскрытие артерии или ее перевязка во время проведения ангиопластики.
Факторы риска инфаркта миокарда:
- Пол (у мужчин чаще).
- Возраст (после 40–65 лет).
- Стенокардия.
- Порок сердца.
- Ожирение.
- Сильный стресс или физическое перенапряжение при имеющейся ИБС и атеросклерозе.
- Сахарный диабет.
- Дислипопротеинемия, чаще гиперлипопротеинемия.
- Курение и прием алкоголя.
- Гиподинамия.
- Артериальная гипертония.
- Ревмокардит, эндокардит или другие воспалительные поражения сердца.
- Аномалии развития коронарных сосудов.
Механизм развития инфаркта миокарда
Течение болезни делится на 5 периодов:
- Прединфарктный (стенокардия).
- Острейший (острая ишемия сосудов сердца).
- Острый (некробиоз с формированием некротической области).
- Подострый (стадия организации).
- Постинфарктный (образование рубца в месте некроза).
Последовательность патогенетических изменений:
- Нарушение целостности атеросклеротического отложения.
- Тромбоз сосуда.
- Рефлекторный спазм поврежденного сосуда.
При атеросклерозе избыточный холестерин откладывается на стенках сосудов сердца, на которых образуются липидные бляшки. Они сужают просвет пораженного сосуда, замедляя кровоток по нему. Различные провоцирующие факторы, будь то гипертонический криз или эмоциональное перенапряжение, приводят к разрыву атеросклеротического отложения и повреждению сосудистой стенки. Нарушение целостности внутреннего слоя артерии активирует защитный механизм в виде свертывающей системы организма. К месту разрыва прилипают тромбоциты, из которых формируется тромб, закупоривающий просвет сосуда. Тромбоз сопровождается выработкой веществ, приводящих к спазмированию сосуда в области повреждения либо по всей его длине.
Клиническое значение имеет сужение артерии на 70% размера ее диаметра, при этом просвет спазмируется до такой степени, что кровоснабжение не может быть компенсировано. Это возникает вследствие атеросклеротических отложений на стенки сосудов и ангиоспазма. В результате нарушается гемодинамика области мышцы, получающей кровь через поврежденное сосудистое русло. При некробиозе страдают кардиомиоциты, недополучая кислород и питательные вещества. Нарушается метаболизм и функционирование сердечной мышцы, ее клетки начинают отмирать. Период некробиоза длится до 7 часов. При незамедлительно оказанной в этот промежуток времени медицинской помощи происходящие изменения в мышце могут быть обратимы.
При формировании некроза в пораженной области восстановить клетки и повернуть процесс вспять невозможно, повреждения приобретают необратимый характер. Страдает сократительная функция миокарда, т.к. некротизированная ткань не участвует в сокращении сердца. Чем обширнее область поражения, тем сильнее снижается сократимость миокарда.
Единичные кардиомиоциты или небольшие их группы гибнут спустя примерно 12 часов от начала острого заболевания. Через сутки микроскопически подтверждается массовое омертвление клеток сердца в зоне поражения. Замещение области некроза соединительной тканью начинается через 7–14 дней от начала инфаркта. Постинфарктный период продолжается 1,5–2 месяца, в течение которых окончательно формируется рубец.
Передняя стенка левого желудочка – наиболее частое место локализации некротической зоны, поэтому в большинстве случаев выявляется трансмуральный ИМ именно этой стенки. Реже поражается верхушечная область, задняя стенка или межжелудочковая перегородка. Инфаркты правого желудочка в кардиологической практике встречаются редко.
Классификация инфаркта миокарда
Относительно размера поражения ткани инфаркт миокарда бывает:
- Мелкоочаговый. Формируется один или несколько маленьких по размеру некротических участков. Диагностируется в 20% случаев от общего числа инфарктников. У 30% пациентов мелкоочаговый инфаркт трансформируется в крупноочаговый.
- Крупноочаговый (чаще трансмуральный). Образуется обширная область некроза.
По глубине некротического поражения различают:
- Трансмуральный. Некротическая область охватывает всю толщу миокарда.
- Субэпикардиальный. Участок с отмершими кардиомиоцитами прилегает к эпикарду.
- Субэндокардиальный. Некроз сердечной мышца в районе прилегания к эндокарду.
- Интрамуральный. Участок некроза находится в толще левого желудочка, но не доходит до эпикарда или эндокарда.
В зависимости от кратности возникновения:
- Первичный. Возникает первый раз.
- Повторный. Развивается через 2 месяца или позже после начала первичного.
- Рецидивирующий. Появляется на стадии формирования рубцовой ткани первичного инфаркта, т.е. в течение первых 2 мес. от первичного острого поражения миокарда.
Относительно локализации процесса:
- Левожелудочковый.
- Правожелудочковый.
- Септальный, или инфаркт межжелудочковой перегородки.
- Сочетанный, к примеру переднебоковой ИМ.
Отталкиваясь от электрокардиологических изменений, фиксируемых на кардиограмме:
- Q-инфаркт. Электрокардиограмма фиксирует сформировавшийся патологический з. Q или желудочковый комплекс QS. Изменения характерны для крупноочаговых ИМ.
- Не Q-инфаркт с инверсией з. Т и без патологии з. Q. Чаще встречается при мелкоочаговых инфарктах.
В зависимости от развития осложнений:
- Неосложненный.
- Осложненный.
Формы острого ИМ, относительно наличия и места расположения болей:
- Типичная. Боль сосредоточена в прекардиальной либо загрудинной области.
- Атипичная. Форма заболевания с атипичной локализацией болей:
Периоды заболевания:
- Острейший.
- Острый.
- Подострый.
- Постинфарктный.
Симптомы инфаркта миокарда
Интенсивность и характер болевых ощущений зависят от нескольких факторов: размера и локализации некротического очага, а также стадии и формы инфаркта. У каждого пациента клинические проявления различны в силу индивидуальных особенностей и состояния сосудистой системы.
Признаки типичной формы инфаркта миокарда
Яркая клиническая картина с типичным и выраженным болевым синдромом наблюдается при крупноочаговом (трансмуральном) инфаркте сердца. Течение болезни разделяю на определенные периоды:
- Прединфарктный, или продромальный период. У 43–45% инфарктников этот период отсутствует, т.к. болезнь начинается внезапно. Большинство пациентов перед инфарктом отмечают учащение приступов стенокардии, загрудинные боли становятся интенсивными и продолжительными. Изменяется общее состояние – снижается настроение, появляется разбитость и страх. Эффективность антиангинальных средств значительно снижается.
- Острейший период (от 30 мин до нескольких часов). При типичной форме острый инфаркт сопровождается нестерпимой загрудинной болью с иррадиацией в левую сторону туловища – руку, нижнюю челюсть, ключицу, предплечье, плечо, область между лопатками. Редко под лопатку или левое бедро. Боли могут быть жгучими, режущими, давящими. Некоторые ощущают распирание в груди или ломоту. В течение нескольких минут боль достигает своего максимума, после чего сохраняется до часа и дольше, то усиливаясь, то ослабевая.
- Острый период (до 2 суток, при рецидивирующем течении до 10 дней и дольше). У подавляющего большинства больных ангинозная боль проходит. Ее сохранение свидетельствует о присоединении эпистеноперикардиального перикардита либо о продолжительном течении ИМ. Нарушения проводимости и ритма сохраняются, также как и артериальная гипотензия.
- Подострый период (длительность – 1 мес). Общее состояние пациентов улучшается: температура нормализуется, проходит одышка. Полностью или частично восстанавливается сердечный ритм, проводимость, звучность тонов, но блокада сердца регрессу не поддается.
- Постинфарктный период – завершающий этап течения острого ИМ, длящийся до 6 месяцев. Некротическая ткань окончательно заменяется плотным рубцом. Сердечная недостаточность устраняется за счет компенсаторной гипертрофии сохранившегося миокарда, но при обширной площади поражения полная компенсация невозможна. В этом случае проявления сердечной недостаточности прогрессируют.
Начало боли сопровождается сильной слабостью, появлением обильного липкого (профузного) пота, чувством страха смерти, учащением сердцебиения. При физикальном обследовании выявляется бледность кожи, липкий пот, тахикардия и другие нарушения ритма (экстрасистолия, фибрилляция предсердий), возбуждение, одышка в покое. В первые минуты повышается артериальное давление, потом резко понижается, что свидетельствует о развивающейся недостаточности сердца и кардиогенном шоке.
При тяжелом течении развивается отек легких, иногда сердечная астма. Тоны сердца при аускультации приглушены. Появление ритма галопа говорит о левожелудочковой недостаточности, от степени выраженности которой зависит аускультативная картина легких. Жесткое дыхание, хрипы (влажные) подтверждают застой крови в легких.
Ангинозная боль в этом периоде нитратами не купируется.
В результате перифокального воспаления и некроза появляется лихорадка, сохраняющаяся на протяжении всего периода. Температура поднимается до 38,50 С, высота ее подъема зависит от размера некротического очага.
При мелкоочаговом инфаркте мышцы сердца симптоматика менее выражена, течение болезни не такое четкое. Редко развивается недостаточность сердца. Аритмия выражается в умеренной тахикардии, которая бывает не у всех больных.
Признаки атипичных форм инфаркта миокарда
Подобные формы характеризуются нетипичной локализацией болей, затрудняющей своевременную установку диагноза.
- Астматическая форма. Характерен кашель, приступы удушья, проливной холодный пот.
- Гастралгическая (абдоминальная) форма проявляется болями в эпигастральной области, рвотой, тошнотой.
- Отечная форма бывает при массивной очаге некроза, приводящем к тотальной сердечной недостаточности с отеками, одышкой.
- Церебральная форма характерна для пожилых пациентов с выраженным атеросклерозом не только сердечных, но и мозговых сосудов. Проявляется клиникой ишемии головного мозга с головокружениями, потерей сознания, шумом в ушах.
- Аритмическая форма. Единственным ее признаком может быть пароксизмальная тахикардия.
- Стертая форма отличается отсутствием жалоб.
- Периферическая форма. Боли могут быть только в руке, подвздошной ямке, нижней челюсти, под лопаткой. Иногда опоясывающая боль схожа с болями, возникающими при межреберной невралгии.
Осложнения и последствия инфаркта миокарда
- Тромбоз в желудочках.
- Острый эрозивный гастрит.
- Острый панкреатит либо колит.
- Парез кишечника.
- Желудочное кровотечение.
- Синдром Дресслера.
- Острая, а в дальнейшем хроническая прогрессирующая недостаточность сердца.
- Кардиогенный шок.
- Постинфарктный синдром.
- Эпистенокардиальный перикардит.
- Тромбоэмболии.
- Аневризма сердца.
- Отек легких.
- Разрыв сердца, приводящий к его тампонаде.
- Аритмии: пароксизмальная тахикардия, экстрасистолия, внутрижелудочковая блокада, фибрилляция желудочков и другие.
- Инфаркт легких.
- Пристеночный тромбоэндокардит.
- Психические и нервные расстройства.
Диагностика инфаркта миокарда
Анамнез болезни, электрокардиографические признаки (изменения на ЭКГ) и характерные сдвиги ферментативной активности в сыворотке крови являются основным критериями при диагностике острого ИМ.
Лабораторная диагностика
В первые 6 часов острого состояния в крови выявляется повышенный уровень белка – миоглобина, участвующего в транспортировке кислорода внутрь кардиомиоцитов. В течение 8–10 часов больше чем на 50% увеличивается креатинфосфокиназа, показатели активности которой нормализуются к концу 2 суток. Этот анализ повторяют каждые 8 часов. Если получают троекратный отрицательный результат, то инфаркт сердца не подтверждается.
На более позднем сроке необходим анализ на определение уровня лактатдегидрогеназы (ЛДГ). Активность этого фермента увеличивается спустя 1–2 суток от начала массового омертвления кардиомиоцитов, по прошествии 1–2 недель приходит в норму. Высокой специфичностью отличается повышение изоформ тропонина, увеличение уровня аминотрансфераз (АСТ, АЛТ). В общем анализе – повышение СОЭ, лейкоцитоз.
Инструментальная диагностика
ЭКГ фиксирует появление отрицательного з. Т либо его двухфазность в определенных отведениях (при мелкоочаговом ИМ), патологии комплекса QRS или з. Q (при крупноочаговом ИМ), а также различные нарушения проводимости, аритмии.
Электрокардиография помогает определить обширность и локализацию области омертвения, оценить сократительную способность сердечной мышцы, выявить осложнения. Рентгенологическое исследование малоинформативно. На поздних этапах проводят коронарографию, выявляющую место, степень сужения или непроходимости коронарной артерии.
Лечение инфаркта миокарда
При подозрении на инфаркт сердца срочно вызывают скорую помощь. До приезда медиков нужно помочь больному принять полусидячее положение с согнутыми в коленях ногами, ослабить галстук, расстегнуть одежду, чтобы она не стягивала грудь и шею. Открыть форточку или окно для доступа свежего воздуха. Под язык положить таблетку аспирина и нитроглицерина, которые предварительно измельчить или попросить больного их разжевать. Это необходимо для более быстрого всасывания действующего вещества и получения скорейшего эффекта. Если ангинозные боли не прошли от одной таблетки нитроглицерина, то его следует рассасывать через каждые 5 минут, но не больше 3 таблеток.
Больной с подозрением на инфаркт сердца подлежит незамедлительной госпитализации в кардиологическую реанимацию. Чем раньше реаниматологи начнут лечение, тем благоприятнее дальнейший прогноз: можно предупредить развитие ИМ, предотвратить появление осложнений, сократить площадь очага некроза.
Основные цели первоочередных лечебных мероприятий:
- снятие болевого синдрома;
- ограничение некротической зоны;
- предотвращение осложнений.
Купирование болевых ощущений – один из важнейших и неотложных этапов лечения ИМ. При неэффективности таблетированного нитроглицерина, его вводят в/в капельно либо наркотический анальгетик (например, морфин) + атропин в/в. В некоторых случаях проводят нейролептанальгезию – в/в нейролептик (дроперидол) + анальгетик (фентанил).
Тромболитическая и антикоагулянтная терапия направлена на сокращение зоны некроза. Впервые сутки от появления первых признаков инфаркта для рассасывания тромба и восстановления кровотока возможно проведение процедуры тромболизиса, но для предотвращения гибели кардиомиоцитов эффективнее ее делать в первые 1–3 часа. Назначают тромболитические препараты – фибринолитики (стрептокиназа, стрептаза), антиагреганты (тромбо-АСС), антикоагулянты (гепарин, варфарин).
Антиаритмическая терапия. Для устранения нарушений ритма, сердечной недостаточности, восстановления метаболизма в ткани сердца применяют антиаритмические препараты (бисопролол, лидокаин, верапамил, атенолол), анаболики (ретаболил), поляризующую смесь и т.д.
Для лечения острой недостаточности сердца используют сердечные гликозиды (коргликон, строфантин), диуретики (фуросемид).
Для устранения психомоторного возбуждения применяют нейролептики, транквилизаторы (седуксен), седативные средства.
Прогноз заболевания зависит от быстроты оказания первой квалифицированной помощи, своевременности проведения реанимационных мероприятий, размера и локализации очага поражения миокарда, наличия либо отсутствия осложнений, возраста пациента и имеющихся у него сопутствующих сердечно-сосудистых патологий.
Источник
Ишемическая болезнь сердца (ИБС) – органическое и функциональное поражение миокарда, вызванное недостатком или прекращением кровоснабжения сердечной мышца (ишемией). ИБС может проявляться острыми (инфаркт миокарда, остановка сердца) и хроническими (стенокардия, постинфарктный кардиосклероз, сердечная недостаточность) состояниями. Клинические признаки ИБС определяются конкретной формой заболевания. ИБС является самой распространенной в мире причиной внезапной смерти, в том числе лиц трудоспособного возраста.
Общие сведения
Ишемическая болезнь сердца является серьезнейшей проблемой современной кардиологии и медицины в целом. В России ежегодно фиксируется около 700 тыс. смертей, вызванных различными формами ИБС, в мире смертность от ИБС составляет около 70%. Ишемическая болезнь сердца в большей степени поражает мужчин активного возраста (от 55 до 64 лет), приводя к инвалидности или внезапной смерти. В группу ИБС входят остро развивающиеся и хронически протекающие состояния ишемии миокарда, сопровождающиеся последующими его изменениями: дистрофией, некрозом, склерозом. Эти состояния рассматриваются, в том числе, и в качестве самостоятельных нозологических единиц.

Ишемическая болезнь сердца
Причины
Подавляющее большинство (97-98%) клинических случаев ИБС обусловлено атеросклерозом коронарных артерий различной степени выраженности: от незначительного сужения просвета атеросклеротической бляшкой до полной сосудистой окклюзии. При 75%-ном коронаростенозе клетки сердечной мышцы реагируют на недостаток кислорода, и у пациентов развивается стенокардия напряжения.
Другими причинами, вызывающими ИБС, служат тромбоэмболия или спазм венечных артерий, развивающиеся обычно на фоне уже имеющегося атеросклеротического поражения. Кардиоспазм усугубляет обструкцию коронарных сосудов и вызывает проявления ишемической болезни сердца.
К факторам, способствующим возникновению ИБС, относятся:
- гиперлипедемия
Способствует развитию атеросклероза и увеличивает риск ишемической болезни сердца в 2-5 раз. Наиболее опасными в плане риска ИБС являются гиперлипидемии типов IIа, IIб, III, IV, а также уменьшение содержания альфа-липопротеинов.
- артериальная гипертония
Артериальная гипертония увеличивает вероятность развития ИБС в 2-6 раз. У пациентов с систолическим АД = 180 мм рт. ст. и выше ишемическая болезнь сердца встречается до 8 раз чаще, чем у гипотоников и людей с нормальным уровнем артериального давления.
- курение
По различным данным, курение сигарет увеличивает заболеваемость ИБС в 1,5-6 раз. Летальность от ишемической болезни сердца среди мужчин 35-64 лет, выкуривающих 20-30 сигарет ежедневно, в 2 раза выше, чем среди некурящих той же возрастной категории.
- гиподинамия и ожирение
Физически малоактивные люди рискуют заболеть ИБС в 3 раза больше, чем лица, ведущие активный образ жизни. При сочетании гиподинамии с избыточной массой тела этот риск возрастает в разы.
- нарушение толерантности к углеводам
При сахарном диабете, в т. ч. латентном, риск заболеваемости ишемической болезнью сердца увеличивается в 2-4 раза.
К факторам, создающим угрозу развития ИБС следует также отнести отягощенную наследственность, мужской пол и пожилой возраст пациентов. При сочетании нескольких предрасполагающих факторов, степень риска в развитии ишемической болезни сердца существенно возрастает.
Причины и скорость развития ишемии, ее длительность и выраженность, исходное состояние сердечно-сосудистой системы индивидуума определяют возникновение той или иной формы ишемической болезни сердца.
Патогенез
В основе развития ИБС лежит дисбаланс между потребностью сердечной мышцы в кровоснабжении и фактическим коронарным кровотоком. Этот дисбаланс может развиваться в связи с резко возросшей потребностью миокарда в кровоснабжении, но недостаточном его осуществлении, либо при обычной потребности, но резком снижении коронарного кровообращения. Дефицит кровоснабжения миокарда особенно выражен в случаях, когда коронарный кровоток снижен, а потребность сердечной мышцы в притоке крови резко возрастает. Недостаточное кровоснабжение тканей сердца, их кислородное голодание проявляется различными формами ишемической болезни сердца.
Классификация
В качестве рабочей классификации, по рекомендации ВОЗ (1979 г.) и ВКНЦ АМН СССР (1984 г.), кардиологами-клиницистами используется следующая систематизация форм ИБС:
1. Внезапная коронарная смерть (или первичная остановка сердца) – внезапно развившееся, непредвиденное состояние, в основе которого предположительно лежит электрическая нестабильность миокарда. Под внезапной коронарной смертью понимается мгновенная или наступившая не позднее 6 часов после сердечного приступа смерть в присутствии свидетелей. Выделяют внезапную коронарную смерть с успешной реанимацией и с летальным исходом.
2. Стенокардия:
- стенокардия напряжения (нагрузки):
- стабильная (с определением функционального класса I, II, III или IV);
- нестабильная: впервые возникшая, прогрессирующая, ранняя послеоперационная или постинфарктная стенокардия;
- спонтанная стенокардия (син. особая, вариантная, вазоспастическая, стенокардия Принцметала)
3. Безболевая форма ишемии миокарда.
4. Инфаркт миокарда:
- крупноочаговый (трансмуральный, Q-инфаркт);
- мелкоочаговый (не Q-инфаркт);
5. Постинфарктный кардиосклероз.
6. Нарушения сердечной проводимости и ритма (форма).
7. Сердечная недостаточность (форма и стадии).
В кардиологии существует понятие «острого коронарного синдрома», объединяющего различные формы ишемической болезни сердца: нестабильную стенокардию, инфаркт миокарда (с Q-зубцом и без Q-зубца). Иногда в эту же группу включают и внезапную коронарную смерть, вызванную ИБС.
Симптомы ИБС
Клинические проявления ИБС определяются конкретной формой заболевания (смотри инфаркт миокарда, стенокардия). В целом ишемическая болезнь сердца имеет волнообразное течение: периоды стабильно нормального самочувствия чередуются с эпизодами обострения ишемии. Около 1/3 пациентов, особенно с безболевой ишемией миокарда, совсем не ощущают наличия ИБС. Прогрессирование ишемической болезни сердца может развиваться медленно, десятилетиями; при этом могут изменяться формы заболевания, а стало быть, и симптомы.
К общим проявлениям ИБС относятся загрудинные боли, связанные с физическими нагрузками или стрессами, боли в спине, руке, нижней челюсти; одышка, усиленное сердцебиение или ощущение перебоев; слабость, тошнота, головокружение, помутнение сознания и обмороки, чрезмерная потливость. Нередко ИБС выявляется уже на стадии развития хронической сердечной недостаточности при появлении отеков на нижних конечностях, выраженной одышке, заставляющей пациента принимать вынужденное сидячее положение.
Перечисленные симптомы ишемической болезни сердца обычно не встречаются одновременно, при определенной форме заболевания наблюдается преобладание тех или иных проявлений ишемии.
Предвестниками первичной остановки сердца при ишемической болезни сердца могут служить приступообразно возникающие ощущения дискомфорта за грудиной, страх смерти, психоэмоциональная лабильность. При внезапной коронарной смерти пациент теряет сознание, происходит остановка дыхания, отсутствует пульс на магистральных артериях (бедренных, сонных), не прослушиваются тоны сердца, расширяются зрачки, кожные покровы становятся бледно-сероватого оттенка. Случаи первичной остановки сердца составляют до 60% летальных исходов ИБС, преимущественно на догоспитальном этапе.
Осложнения
Гемодинамические нарушения в сердечной мышце и ее ишемические повреждения вызывают многочисленные морфо-функциональные изменения, определяющие формы и прогноз ИБС. Результатом ишемии миокарда являются следующие механизмы декомпенсации:
- недостаточность энергетического метаболизма клеток миокарда – кардиомиоцитов;
- «оглушенный» и «спящий» (или гибернирующий) миокард – формы нарушения сократимости левого желудочка у пациентов с ИБС, имеющие преходящий характер;
- развитие диффузного атеросклеротического и очагового постинфарктного кардиосклероза – уменьшение количества функционирующих кардиомиоцитов и развитие на их месте соединительной ткани;
- нарушение систолической и диастолической функций миокарда;
- расстройство функций возбудимости, проводимости, автоматизма и сократимости миокарда.
Перечисленные морфо-функциональные изменения миокарда при ИБС приводят к развитию стойкого снижения коронарного кровообращения, т. е. сердечной недостаточности.
Диагностика
Диагностику ИБС осуществляют кардиологи в условиях кардиологического стационара или диспансера с использованием специфических инструментальных методик. При опросе пациента выясняются жалобы и наличие характерных для ишемической болезни сердца симптомов. При осмотре определяются наличие отеков, цианоза кожных покровов, шумов в сердце, нарушений ритма.
Лабораторно-диагностические анализы предполагают исследование специфических ферментов, повышающихся при нестабильной стенокардии и инфаркте (креатинфосфокиназы (в течение первых 4—8 часов), тропонина-I (на 7—10 сутки), тропонина-Т (на 10—14 сутки), аминотрансферазы, лактатдегидрогеназы, миоглобина (в первые сутки)). Эти внутриклеточные белковые ферменты при разрушении кардиомиоцитов высвобождаются в кровь (резорбционно-некротический синдром). Также проводится исследование уровня общего холестерина, липопротеидов низкой (атерогенных) и высокой (антиатерогенных) плотности, триглицеридов, сахара крови, АЛТ и АСТ (неспецифических маркеров цитолиза).
Важнейшим методом диагностики кардиологических заболеваний, в т. ч. ишемической болезни сердца, является ЭКГ – регистрация электрической активности сердца, позволяющая обнаружить нарушения нормального режима работы миокарда. ЭхоКГ – метод УЗИ сердца позволяет визуализировать размеры сердца, состояние полостей и клапанов, оценить сократимость миокарда, акустические шумы. В некоторых случаях при ИБС проводят стресс эхокардиографию – ультразвуковую диагностику с применением дозированной физической нагрузки, регистрирующую ишемию миокарда.
В диагностике ишемической болезни сердца широко используются функциональные пробы с нагрузкой. Они применяются для выявления ранних стадий ИБС, когда нарушения еще невозможно определить в состоянии покоя. В качестве нагрузочных тестов используются ходьба, подъем по лестнице, нагрузки на тренажерах (велотренажере, беговой дорожке), сопровождающиеся ЭКГ-фиксацией показателей работы сердца. Ограниченность применения функциональных проб в ряде случаев вызвана невозможностью выполнения пациентами требуемого объема нагрузки.
Холтеровское суточное мониторирование ЭКГ предполагает регистрацию ЭКГ, выполняемую в течение суток и выявляющую периодически возникающие нарушения в работе сердца. Для исследования используется портативный аппарат (холтеровский монитор), фиксируемый на плече или поясе пациента и снимающий показания, а также дневник самонаблюдения, в котором пациент отмечает по часам свои действия и происходящие изменения в самочувствии. Полученные в ходе мониторирования данные обрабатываются на компьютере. ЭКГ-мониторирование позволяет не только выявить проявления ишемической болезни сердца, но также причины и условия их возникновения, что особенно важно в диагностике стенокардии.
Чрезпищеводная электрокардиография (ЧПЭКГ) позволяет детально оценить электрическую возбудимость и проводимость миокарда. Суть метода состоит во введении датчика в пищевод и регистрации показателей работы сердца, минуя помехи, создаваемые кожными покровами, подкожно-жировой клетчаткой, грудной клеткой.
Проведение коронарографии в диагностике ишемической болезни сердца позволяет контрастировать сосуды миокарда и определять нарушения их проходимости, степень стеноза или окклюзии. Коронарография используется для решения вопроса об операции на сосудах сердца. При введении контрастного вещества возможны аллергические явления, в т. ч. анафилаксия.
Лечение ИБС
Тактика лечения различных клинических форм ишемической болезни сердца имеет свои особенности. Тем не менее, можно обозначить основные направления, применяемые для лечения ИБС:
- немедикаментозная терапия;
- лекарственная терапия;
- проведение хирургической реваскуляризации миокарда (аорто-коронарного шунтирования);
- применение эндоваскулярных методик (коронарной ангиопластики).
К немедикаментозной терапии относятся мероприятия по коррекции образа жизни и питания. При различных проявлениях ИБС показано ограничение режима активности, т. к. при физической нагрузке происходит увеличение потребности миокарда в кровоснабжении и кислороде. Неудовлетворенность этой потребности сердечной мышцы фактически и вызывает проявления ИБС. Поэтому при любых формах ишемической болезни сердца ограничивается режим активности пациента с последующим постепенным расширением его во время реабилитации.
Диета при ИБС предусматривает ограничение приема воды и соли с пищей для снижения нагрузки на сердечную мышцу. С целью замедления прогрессирования атеросклероза и борьбы с ожирением также назначается низкожировая диета. Ограничиваются, а по возможности, исключаются следующие группы продуктов: жиры животного происхождения (сливочное масло, сало, жирное мясо), копченая и жареная пища, быстро всасывающиеся углеводы (сдобная выпечка, шоколад, торты, конфеты). Для поддержания нормального веса необходимо соблюдать баланс между потребляемой и расходуемой энергией. При необходимости снижения веса дефицит между потребляемыми и расходуемыми энергозапасами должен составлять минимум 300 кКл ежедневно, с учетом, что за сутки при обычной физической активности человек тратит около 2000—2500 кКл.
Лекарственная терапия при ИБС назначается по формуле «A-B-C»: антиагреганты, β-адреноблокаторы и гипохолестеринемические препараты. При отсутствии противопоказаний возможно назначение нитратов, диуретиков, антиаритмических препаратов и др. Отсутствие эффекта от проводимой лекарственной терапии ишемической болезни сердца и угроза развития инфаркта миокарда являются показанием к консультации кардиохирурга для решения вопроса об оперативном лечении.
К хирургической реваскуляризации миокарда (аортокоронарное шунтирование – АКШ) прибегают с целью восстановления кровоснабжения участка ишемии (реваскуляризации) при резистентности к проводимой фармакологической терапии (например, при стабильной стенокардии напряжения III и IV ФК). Суть метода АКШ заключается в наложении аутовенозного анастомоза между аортой и пораженной артерией сердца ниже участка ее сужения или окклюзии. Тем самым создается обходное сосудистое русло, доставляющее кровь к участку ишемии миокарда. Операции АКШ могут проводиться с использованием искусственного кровообращения или на работающем сердце. К малоинвазивным хирургическим методикам при ИБС относится чрескожная транслюминальная коронарная ангиопластика (ЧТКА) – баллонное «расширение» стенозированного сосуда с последующей имплантацией каркас-стента, удерживающего достаточный для кровотока просвет сосуда.
Прогноз и профилактика
Определение прогноза при ИБС зависит от взаимосвязи различных факторов. Так неблагоприятно сказывается на прогнозе сочетание ишемической болезни сердца и артериальной гипертонии, тяжелых расстройств липидного обмена и сахарного диабета. Лечение может лишь замедлить неуклонное прогрессирование ИБС, но не остановить ее развитие.
Самой эффективной профилактикой ИБС является снижение неблагоприятного воздействия факторов угрозы: исключение алкоголя и табакокурения, психоэмоциональных перегрузок, поддержание оптимальной массы тела, занятия физкультурой, контроль АД, здоровое питание.
Источник
