Ишемическая болезнь сердца инфаркт миокарда патогенез это
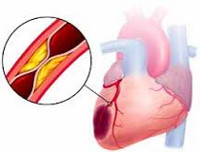
ИБС – острая или хроническая дисфункция миокарда вследствие относительного или абсолютного уменьшения снабжения миокарда артериальной кровью, чаще всего связанная с патологическим процессом в системе коронарных артерий (КА).
Этиология ИБС:
1. Атеросклероз КА – чаще поражается передняя нисходящая ветвь левой КА, реже – огибающая ветвь левой КА и правая КА.
2. Врожденные аномалии КА (отхождение огибающей артерии от правого коронарного синуса или правой коронарной артерии и др.)
3. Расслаивание КА (спонтанное или вследствие расслаивания аневризмы аорты)
4. Воспалительные поражения КА (при системных васкулитах)
5. Сифилитический аортит с распространением процесса на КА
6. Лучевой фиброз КА (после облучения средостения при лимфогранулематозе и др. опухолях)
7. Эмболия КА (чаще при ИЭ, МА, реже – при ревматических пороках)
В настоящее время ИБС считается ишемия миокарда, вызванная только атеросклеротическим процессом в КА.
Факторы риска ИБС:
а. Модифицируемые: 1) курение сигарет 2) артериальная гипертензия 3) сахарный диабет 4) низкий ХС ЛПВП, высокий ХС ЛПНП, общий ХС выше 6,5 ммоль/л 5) ожирение
б. Немодифицируемые: 1) возраст: 55 лет и старше у мужчин, 65 лет и старше у женщин 2) мужской пол 3) семейная отягощенность по ИБС
Также выделяют основные (возраст старше 65 лет для женщин и старше 55 лет для мужчин, курение, общий ХС > 6,5 ммоль/л, семейная отягощенность по ИБС) и прочие (низкий ХС ЛПВП, высокий ХС ЛПНП, нарушение толерантности к глюкозе, ожирение, микроальбуминурия при СД, малоподвижный образ жизни, повышение уровня фибриногена) факторы риска ИБС.
Патогенез ИБС.
В норме между доставкой кислорода к кардиомиоцитам и потребностью в нем имеется четкое соответствие, обеспечивающее нормальный метаболизм и функции клеток сердца. Коронарный атеросклероз вызывает:
а) механическую обструкцию КАсо снижением перфузии клеток
б) динамическую обструкцию КА – коронароспазм – из-за повышенной реактивности пораженных атеросклерозом КА к действию вазоконстрикторов (катехоламинам, серотонину, эндотелину, тромбоксану) и сниженной реактивности к действию вазодилататоров (эндотелиальному релаксирующему фактору, простациклину)
в) нарушение микроциркуляции – из-за склонности к образованию нестойких тромбоцитарных агрегатов в пораженных КА при выделении ряда БАВ (тромбоксана А2 и др.), которые часто подвергаются спонтанной дезагрегации
г) коронаротромбоз – в области повреждения атеросклеротической бляшки на тромбогенном субэндотелии формируются тромбы, потенцирующие ишемию
Все вышеперечисленное приводит к дисбалансу между потребностью миокарда в кислорода и его доставкой, нарушению перфузии сердца и развитию ишемии с последующими клиническими проявлениями в виде ангинозной боли, ИМ и др.
Классификация ИБС:
1. Внезапная коронарная смерть (первичная остановка кровообращения).
2. Стенокардия:
а) стенокардия напряжения: 1) впервые возникшая (до 1 мес); 2) стабильная (больше 1 мес); 3) прогрессирующая
б) спонтанная (вазоспастическая, особая, вариантная, стенокардия Принцметала)
3. Инфаркт миокарда: а) с Q-зубцом (крупноочаговый – трансмуральный и нетрансмуральный) б) без Q-зубца (мелкоочаговый)
4. Постинфарктный кардиосклероз (через 2 мес после ИМ)
5. Нарушения сердечного ритма
6. Сердечная недостаточность
7. Безболевая («немая») ишемия
8. Микроваскулярная (дистальная) ИБС
9. Новые ишемические синдромы (оглушение миокарда, гибернация миокарда, ишемическое прекондиционирование миокарда)
Некоторые клинические формы ИБС – впервые возникшая стенокардия, прогрессирующая стенокардия, стенокардия покоя и ранняя постинфарктная стенокардия (первые 14 дней после ИМ) – являются формами нестабильной стенокардии.
Лечение – см. вопрос 20.
20. Ишемическая болезнь сердца: стенокардия. Этиология, патогенез, клинические варианты, дифференциальная диагностика. Тактика ведения больных, принципы лечения. Медико-социальная экспертиза. Реабилитация.
Стенокардия – заболевание, характеризующееся приступами загрудинных болей, возникающими в ответ на повышение кислородно-метаболической потребности миокарда вследствие физического или эмоционального напряжения; это синдромное понятие, клинически характеризующееся рядом признаков:
1) условия возникновения боли – физическая нагрузка или эмоциональное напряжение, выход на холодный воздух
2) характер болевых ощущений – сжимающий, жгучий, давящий
3) локализация боли – загрудинная область или предсердечная область слева от грудины
4) иррадиация боли – в левую руку по ульнарному краю к мизинцу, в левую лопатку, нижнюю челюсть
5) продолжительность болевых ощущений – 2-3 минуты, но не более 10-15 мин; исчезают после уменьшения или прекращения физической нагрузки
6) боль быстро и полно купируется после приема нитроглицерина через 3-5, но не более чем через 10 мин
Основные клинические формы стенокардии и их характеристика.
1. Стенокардия напряжения:
а) впервые возникшая – давность заболевания до 1 мес; характеризуется полиморфностью течения – может регрессировать, перейти в стабильную стенокардию или принять прогрессирующее течение, поэтому требует усиленного наблюдения и лечения
б) стабильная (с указанием функионального класса) – давность заболевания более 1 мес; характерны стереотипные боли в ответ на обычную для даннорго больного нагрузку
в) прогрессирующая – формируется чаще на фоне стабильности; характерны нарастающие по частоте, продолжительности и интенсивности ангинозные приступы с резким уменьшением переносимости больными физических нагрузок, с расширением зоны локализации, путей иррадиации болей и ослаблением эффекта от приема нитроглицерина.
2. Спонтанная (особая) стенокардия – характерны приступы ангинозных болей, возникающие без видимой связи с факторами, ведующими к повышению потребности миокарда в кислороде; у большинства больных болевой синдром развивается в строго определенное время суток (чаще ночью или в момент пробуждения), структурно состоит из цепочки 3-5 болевых эпизодов, чередующихся с безболевыми паузами
3. Безболевая («немая») стенокардия – диагностируется при выявлении четких ишемических изменений на ЭКГ в процессе суточного мониторирования или проведения нагрузочных проб, не проявляющихся клиническими признаками
4. Микроваскулярная стенокардия (синдром Х) – характерна типичная клиническая картина стенокардии, выявление ишемии на ЭКГ при нагрузочных или фармакологических пробах при неизмененных КА по данным коронарографии; обусловлена дефектной эндотелийзависимой вазодилатацией мелких миокардиальных артериол, что приводит к снижению резерва коронарного кровотока и ишемии миокарда
Диагностика стенокардии.
1. Данные анамнеза (условия возникновения болей) и характерная клиническая картина.
2. ЭКГ: в покое и во время приступа, Холтеровское мониторирование – специфическим для стенокардии является дислокация сегмента ST на 1 мм вниз (субэндокардиальная ишемия) или вверх (трансмуральная ишемия) от изолинии, чаще всего регистрируемая в момент приступа
3. Нагрузочные тесты: ВЭП, тредмил, чрезпищеводная кардиостимуляция (в ответ на повышение ЧСС возникают ишемические повреждения на ЭКГ), фармакологические пробы с добутамином и изадрином (вызывают повышение потребности миокарда в кислороде), дипиридамолом и аденозином (вызывают синдром обкрадывания, расширяя прежде всего интактные сосуды) – позволяют выявить ишемию миокарда, не определяемую в покое, установить степень выраженности коронарной недостаточности.
Признаки ишемии миокарда во время нагрузочного тестирования:
а) возникновение приступа стенокардии
б) депрессия или элевация сегмента ST горизонтального или косонисходящего типа на 1 мм и более продолжительностью не менее 0,8 сек от точки j
в) увеличение амплитуды зубца R в сочетании с депрессией сегмента ST
4. Радионуклидная сцинциграфия миокарда с 201Тl (поглощается нормальным миокардом пропорционально коронарной перфузии) или 99mTc (избирательно накапливается в зонах некроза миокарда)
5. Эхо-КГ (в т.ч. стресс-Эхо-КГ, Эхо-КГ с фармакологическими пробами) – позволяет оценить локальную и большую сократимость миокарда (нарушение локальной сократимости соответствует очагу ишемии)
6. Коронарография – «золотой стандарт» для диагностики ИБС; выполняется чаще для решения вопроса о целесообразности хирургического лечения
7. Электрокардиотопография – ЭКГ-картирование по 60 отведениям
8. Позитронно-эмиссионнная томография – позволяет получить информацию о коронарном кровотоке и жизнеспособности миокарда
9. Обязательные лабораторные обследования: ОАК, ОАМ, сахар крови, БАК (липидограмма, электролиты, кардиоспецифические ферменты: КФК, АСТ, ЛДГ, миоглобин, тропонин Т), коагулограмма.
Функциональные классы стенокардии позволяют оценить функциональное состояние больных ИБС и переносимость ими физических нагрузок:
| Критерий | ФК I | ФК II | ФК III | ФК IV |
| Условия возникновения стенокардии | Повышенная физическая нагрузка (интенсивная, длительная, быстрая) | Значительная физическая нагрузка (ходьба по ровному месту >500 м, подъем >, чем на 1 этаж) | Незначительная физическая нагрузка (ходьба по ровному месту в пределах 100-500 м, подъем на 1 этаж) | Малейшая физическая нагрузка: ходьба на ровном месте < 100 м); приступы стенокардии в покое |
| Ограничение обычной физической активности | Не ограничена | Незначительно ограничена | Значительно ограничена | Неспособность выполнять любую физическую нагрузку |
| W – величина освоенной нагрузки при ВЭП, м*кг/мин | > 750 (или > 125 Ватт) | 450 – 750 (или 75-100 Ватт) | 300 – 450 (или 50 Ватт) | > 150 (или 25 Ватт) |
| Двойное произведение = ЧСС * АДсист/100 | > 278 | 216 – 277 | 151 – 215 | < 150 |
Принципы лечения стенокардии:
1. Рекомендации по изменению стиля жизни: снижение массы тела при ожирении; отказ от вредных привычек (курения, злоупотребления алкоголем); стабилизация гипертензии и сахарного диабета
рациональная диета (ограничение жирной и соленой пищей, не есть перед сном); занятия лечебной физкультурой
2. Медикаментозное лечение – основные группы препаратов:
а) антиангинальные средства (донаторы оксида азота) – нитраты (нитроглицерин, изосорбида динитрат, изосорбида-5-мононитрат), сиднонимины (молсидомин, корватон, сиднофарм).
1) препараты нитроглицерина: сублингвальные формы (нитроглицерин таб. 0,5 мг), оральные аэрозоли (нитроминт), депо-препараты (нитронг-форте: разовая доза 6,5 мг, суточная 13,0-26,0 мг, сустак мите/форте, нитрогранулонг: разовая доза 5,3 мг, суточная 10,6-15,9 мг, нитро-тайм), мази и пластыри для накожного применения (нитродерм, депонит-5,10: разовая доза 1 пластырь, в сутки до 3-х пластырей, нитромазь 2%: разовая доза 1 г, суточная 2 г), инфузионные формы (перлинганит, нитроглицерин для инфузий)
2) препараты изосорбида динитрата: пероральные формы (кардикет ретард: разовая доза 20-120 мг, суточная 60-120 мг, изосорб ретард, изолонг, нитросорбид: разовая доза 10-20 мг, суточная 40-80 мг), оральные аэрозоли (изокет, аэросонит, изо-мик), инфузионные формы (изокет, изолонг), буккальные формы (тринитролонг, динитросорбилонг)
3) изосорбида мононитрат: пероральные формы (мононит: разовая доза 20-40 мг, суточная 80-120 мг, оликард: разовая доза 40 мг, суточная 40-80 мг, моночинкве: разовая доза 50 мг, суточная 50 мг).
б) β-адреноблокаторы:
1) без вазодилатирующих свойств:
– неселективные (пропранолол / обзидан 120-240 мг/сут, надолол, окспренолол, соталол, тимолол)
– β1-селективные (атенолол / тенормин – 100-150 мг/сут, бисопролол / конкор 2,5-10 мг/сут, метопролол / эгилок 100-200 мг/сут)
2) с вазодилатирующими свойствами:
– неселективные (карведилол / дилатренд 12,5-50 мг/сут, пиндолол, лабеталол)
– β1-селективные (небиволол / небилет 5-10 мг/сут, ацебутолол / сектраль 200-800 мг/сут).
Противопоказаны при: а) интервал P–Q более 0,24 с; б) ЧСС менее 50 в 1 минуту; в) уровень систолического АД менее 90 мм. рт. ст.; г) АВ блокада II–III степени (при отсутствующем электрокардиостимуляторе); д) БА, ХОБЛ; е) выраженная СН.
в) антагонисты кальция (верапамил, дилтиазем и др.): учащающие пульс (дигидропиридиновые – нифедипин 30-60 мг/сут, амлодипин 5-10 мг/сут, исрадипин) и замедляющие пульс (верапамил 240-480 мг/сут, дилтиазем 90-120 мг/сут); препараты выбора при вазоспастической стенокардии
г) антитромбоцитарные препараты: аспирин – достоверно снижает смертность больным ИМ, поэтому при ИМ всем пациентам, которые не принимали аспирин в течение последних суток, немедленно назначается в дозе 0,160-0,325 мг внутрь разжевать
д) ингибиторы АПФ (при наличии АГ или снижении ФВ левого желудочка менее 40%)
е) противоатеросклеротические (гиполипидемические) средства (симвастатин, правастатин и др.)
ж) метаболические средства (триметазидин, триметазидин MB / предуктал 40-60 мг/сут).
Достоверно продлевают жизнь больных со стенокардией: β-адреноблокаторы; ингибиторы АПФ (при наличии ЛЖ недостаточности); аспирин; амиодарон (ПАС III, нельзя одновременно с β-блокаторами).
3. Дополнительные методы лечения:
Источник
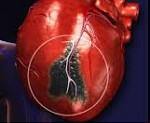
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
Общие сведения
Инфаркт миокарда – очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Клинически проявляется жгущими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Развившийся инфаркт миокарда служит показанием к экстренной госпитализации в кардиологическую реанимацию. При неоказании своевременной помощи возможен летальный исход.
В возрасте 40-60 лет инфаркт миокарда в 3–5 раз чаще наблюдается у мужчин в связи с более ранним (на 10 лет раньше, чем у женщин) развитием атеросклероза. После 55-60 лет заболеваемость среди лиц обоего пола приблизительно одинакова. Показатель летальности при инфаркте миокарда составляет 30—35%. Статистически 15—20% внезапных смертей обусловлены инфарктом миокарда.
Нарушение кровоснабжения миокарда на 15-20 и более минут приводит к развитию необратимых изменений в сердечной мышце и расстройству сердечной деятельности. Острая ишемия вызывает гибель части функциональных мышечных клеток (некроз) и последующее их замещение волокнами соединительной ткани, т. е. формирование постинфарктного рубца.
В клиническом течении инфаркта миокарда выделяют пять периодов:
- 1 период – предынфарктный (продромальный): учащение и усиление приступов стенокардии, может продолжаться несколько часов, суток, недель;
- 2 период – острейший: от развития ишемии до появления некроза миокарда, продолжается от 20 минут до 2 часов;
- 3 период – острый: от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани), длительность от 2 до 14 суток;
- 4 период – подострый: начальные процессы организации рубца, развитие грануляционной ткани на месте некротической, продолжительность 4-8 недель;
- 5 период – постинфарктный: созревание рубца, адаптация миокарда к новым условиям функционирования.

Инфаркт миокарда
Причины инфаркта миокарда
Инфаркт миокарда является острой формой ИБС. В 97—98% случаев основой для развития инфаркта миокарда служит атеросклеротическое поражение венечных артерий, вызывающее сужение их просвета. Нередко к атеросклерозу артерий присоединяется острый тромбоз пораженного участка сосуда, вызывающий полное или частичное прекращение кровоснабжения соответствующей области сердечной мышцы. Тромбообразованию способствует повышенная вязкость крови, наблюдаемая у пациентов с ИБС. В ряде случаев инфаркт миокарда возникает на фоне спазма ветвей венечных артерий.
Развитию инфаркта миокарда способствуют сахарный диабет, гипертоничесая болезнь, ожирение, нервно-психическое напряжение, увлечение алкоголем, курение. Резкое физическое или эмоциональное напряжение на фоне ИБС и стенокардии может спровоцировать развитие инфаркта миокарда. Чаще развивается инфаркт миокарда левого желудочка.
Классификация инфаркта миокарда
В соответствии с размерами очагового поражения сердечной мышцы выделяют инфаркт миокарда:
- крупноочаговый
- мелкоочаговый
На долю мелкоочаговых инфарктов миокарда приходится около 20% клинических случаев, однако нередко мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый инфаркт миокарда (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых инфарктах не возникают аневризма и разрыв сердца, течение последних реже осложняется сердечной недостаточностью, фибрилляцией желудочков, тромбоэмболией.
В зависимости от глубины некротического поражения сердечной мышцы выделяют инфаркт миокарда:
- трансмуральный – с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый)
- интрамуральный – с некрозом в толще миокарда
- субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду
- субэпикардиальный – с некрозом миокарда в зоне прилегания к эпикарду
По изменениям, фиксируемым на ЭКГ, различают:
- «Q-инфаркт» – с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще крупноочаговый трансмуральный инфаркт миокарда)
- «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще мелкоочаговый инфаркт миокарда)
По топографии и в зависимости от поражения определенных ветвей коронарных артерий инфаркт миокарда делится на:
- правожелудочковый
- левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки
По кратности возникновения различают инфаркт миокарда:
- первичный
- рецидивирующий (развивается в срок 8 недель после первичного)
- повторный (развивается спустя 8 недель после предыдущего)
По развитию осложнений инфаркт миокарда подразделяется на:
- осложненный
- неосложненный
По наличию и локализации болевого синдрома выделяют формы инфаркта миокарда:
- типичную – с локализацией боли за грудиной или в прекардиальной области
- атипичные – с атипичными болевыми проявлениями:
- периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная)
- безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная
- малосимптомную (стертую)
- комбинированную
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
- стадию ишемии (острейший период)
- стадию некроза (острый период)
- стадию организации (подострый период)
- стадию рубцевания (постинфарктный период)
Симптомы инфаркта миокарда
Предынфарктный (продромальный) период
Около 43% пациентов отмечают внезапное развитие инфаркта миокарда, у большей же части больных наблюдается различный по продолжительности период нестабильной прогрессирующей стенокардии.
Острейший период
Типичные случаи инфаркта миокарда характеризуются чрезвычайно интенсивным болевым синдромом с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения миокарда, тем более выражена боль.
Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов, а иногда и суток, не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью, возбуждением, чувством страха, одышкой.
Возможно атипичное течение острейшего периода инфаркта миокарда.
У пациентов отмечается резкая бледность кожных покровов, липкий холодный пот, акроцианоз, беспокойство. Артериальное давление в период приступа повышено, затем умеренно или резко снижается по сравнению с исходным (систолическое < 80 рт. ст., пульсовое < 30 мм мм рт. ст.), отмечается тахикардия, аритмия.
В этот период может развиться острая левожелудочковая недостаточность (сердечная астма, отек легких).
Острый период
В остром периоде инфаркта миокарда болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита.
В результате процессов некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Длительность и высота подъема температуры при лихорадке зависят от площади некроза. Артериальная гипотензия и признаки сердечной недостаточности сохраняются и нарастают.
Подострый период
Болевые ощущения отсутствуют, состояние пациента улучшается, нормализуется температура тела. Симптомы острой сердечной недостаточности становятся менее выраженными. Исчезает тахикардия, систолический шум.
Постинфарктный период
В постинфарктном периоде клинические проявления отсутствуют, лабораторные и физикальные данные практически без отклонений.
Атипичные формы инфаркта миокарда
Иногда встречается атипичное течение инфаркта миокарда с локализацией болей в нетипичных местах (в области горла, пальцах левой руки, в зоне левой лопатки или шейно-грудного отдела позвоночника, в эпигастрии, в нижней челюсти) или безболевые формы, ведущими симптомами которых могут быть кашель и тяжелое удушье, коллапс, отеки, аритмии, головокружение и помрачение сознания.
Атипичные формы инфаркта миокарда чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, недостаточностью кровообращения, на фоне повторного инфаркта миокарда.
Однако атипично протекает обычно только острейший период, дальнейшее развитие инфаркта миокарда становится типичным.
Стертое течение инфаркта миокарда бывает безболевым и случайно обнаруживается на ЭКГ.
Осложнения
Нередко осложнения возникают уже в первые часы и дни инфаркта миокарда, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды аритмий: экстрасистолия, синусовая или пароксизмальная тахикардия, мерцательная аритмия, полная внутрижелудочковая блокада. Наиболее опасно мерцание желудочков, которое может перейти в фибрилляцию и привести к гибели пациента.
Левожелудочковая сердечная недостаточность характеризуется застойными хрипами, явлениями сердечной астмы, отека легких и нередко развивается в острейший период инфаркта миокарда. Крайне тяжелой степенью левожелудочковой недостаточности является кардиогенный шок, развивающийся при обширном инфаркте и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит падение систолического АД ниже 80 мм рт. ст., нарушение сознания, тахикардия, цианоз, уменьшение диуреза.
Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца – кровоизлияние в полость перикарда. У 2-3% пациентов инфаркт миокарда осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения.
Пациенты с обширным трансмуральным инфарктом миокарда в первые 10 суток могут погибнуть от разрыва желудочка вследствие острого прекращения кровообращения. При обширном инфаркте миокарда может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к сердечной недостаточности.
Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный синдром, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией.
Диагностика инфаркта миокарда
Среди диагностических критериев инфаркта миокарда важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при инфаркте миокарда зависят от формы (типичной или атипичной) заболевания и обширности поражение сердечной мышца. Инфаркт миокарда следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой сердечной недостаточности.
К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном инфаркте миокарда), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном инфаркте миокарда). При ЭхоКГ выявляется нарушение локально сократимости желудочка, истончение его стенки.
В первые 4-6 часов после болевого приступа в крови определяется повышение миоглобина – белка, осуществляющего транспорт кислорода внутрь клеток.Повышение активности креатинфосфокиназы (КФК) в крови более чем на 50% наблюдается спустя 8—10 ч от развития инфаркта миокарда и снижается до нормы через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. Инфаркт миокарда исключается при трех отрицательных результатах.
Для диагностики инфаркта миокарда на более поздних сроках прибегают к определению фермента лактатдегидрогеназы (ЛДГ), активность которой повышается позже КФК – спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для инфаркта миокарда является повышение изоформ миокардиального сократительного белка тропонина – тропонина-Т и тропонина-1, увеличивающихся также при нестабильной стенокардии. В крови определяется увеличение СОЭ, лейкоцитов, активности аспартатаминотрансферазы (АсАт) и аланинаминотрансферазы (АлАт).
Коронарная ангиография (коронарография) позволяет установить тромботическую окклюзию коронарной артерии и снижение желудочковой сократимости, а также оценить возможности проведения аортокоронарного шунтирования или ангиопластики – операций, способствующих восстановлению кровотока в сердце.
Лечение инфаркта миокарда
При инфаркте миокарда показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение инфаркта миокарда и осуществляется постепенное расширение режима.
Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина.
Терапия при инфаркте миокарда направлена на предупреждение и устранение аритмий, сердечной недостаточности, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß-адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д.
В первые 24 часа после развития инфаркта миокарда можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики.
Прогноз при инфаркте миокарда
Инфаркт миокарда является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после инфаркта миокарда. Насосная способность сердца связана с локализацией и объемом зоны инфаркта. При повреждении более 50% миокарда, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается сердечная недостаточность.
По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением инфаркта миокарда.
Профилактика инфаркта миокарда
Необходимыми условиями профилактики инфаркта миокарда являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
Источник
