Инфаркт печени при инфаркте миокарда

Инфаркт печени — это некроз гепатоцитов, обусловленный недостаточным поступлением крови и кислорода. В основном возникает на фоне тяжелой сердечно-сосудистой патологии. Типичные клинические проявления: боли в области правого подреберья, тошнота, рвота, лихорадка. Также характерны отеки ног и набухание шейных вен. Для диагностики инфаркта проводятся биохимические печеночные пробы, инструментальные методы — УЗИ, КТ, ангиография. При некрозе печени показано лечение первопричины болезни, которое предполагает активизацию гемодинамики, устранение шока и нормализацию дыхательной функции.
Общие сведения
Инфаркт печени в медицинской литературе имеет несколько синонимов — шоковая печень, ишемический (гипоксический, токсический) гепатит. Распространенность заболевания среди госпитализированных в стационар пациентов составляет в среднем 1 случай на 1000 больных. Наиболее часто инфаркт наблюдается среди страдающих кардиогенным (22%) и септическим шоком (13,8%). В терапевтических отделениях гипоксический гепатит встречается крайне редко — не более 0,03%. В 80% случаев печеночный инфаркт регистрируется у больных пожилого и старческого возраста.
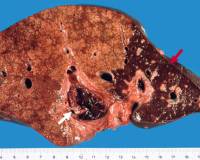
Инфаркт печени
Причины
Инфаркт печени возникает как при системных нарушениях гемодинамики, так и вследствие локальных сосудистых поражений. В исключительных случаях этиологическими факторами болезни служат медицинские манипуляции: неселективная ангиография, радиоабляция опухоли и другие вмешательства на печеночной паренхиме. В современной гастроэнтерологии выделяют 4 основные причины, которые вызывают инфаркт печени:
- Сердечная недостаточность. Является основным этиологическим фактором — вызывает около 50% случаев ишемии паренхимы печени. Гипоксический гепатит зачастую развивается при острой левожелудочковой недостаточности, спровоцированной инфарктом миокарда, жизнеугрожающими аритмиями, декомпенсацией кардиомиопатий.
- Токсико-септический шок. Сепсис обуславливает от 15% до 30% случаев инфаркта печени. При септическом шоке абдоминальный кровоток усиливается, но из-за функциональных нарушений печеночные клетки могут поглотить не больше 15% кислорода. Такая ситуация вызвана эндотоксемией и синдромом гипердинамической циркуляции.
- Дыхательная недостаточность. Гипоксемия и гипоксия являются причинами 15% случаев ишемического гепатита. Снижение парциального давления кислорода в крови встречается при хронических бронхолегочных заболеваниях, ателектазах, обструкции дыхательных путей.
- Локальные нарушения кровотока. Недостаточное поступление крови по печеночной артерии может быть вызвано тромбозом, эмболией, травматическим разрывом или сдавлением сосуда опухолью. Обтурация воротной вены происходит при пилетромбозе, компрессии извне. Редкой причиной является перекрут добавочной доли печени.
В литературе описана связь гипоксического поражения печеночной паренхимы с редкими болезнями — серповидно-клеточной анемией, синдромом Бадда-Киари, наследственной геморрагической телеангиэктазией (болезнью Рандю-Ослера). Иногда инфаркт печени связан с острой кровопотерей, тепловым ударом, ночным апноэ.
К факторам риска относят осложненные аневризмы и другие мальформации печеночной артерии, системные васкулиты. Вероятность развития инфаркта выше у больных с миелопролиферативными процессами и перенесших полостные операции.
Патогенез
В норме печеночный кровоток составляет около 20-25% сердечного выброса и обеспечивается двумя сосудами — печеночной артерией и портальной веной. Если ишемический гепатит обусловлен системными причинами, то основным патогенетическим механизмом инфаркта является критическое падение сердечного выброса с последующей гипоксией паренхимы. Поражение гепатоцитов связано не только со снижением доставки кислорода, но и с неспособностью клеток извлекать его из крови.
При обструкции кровоснабжающего печень сосуда наблюдаются локальные инфаркты, размер которых зависит от уровня поражения. При окклюзии основного сосудистого ствола формируются гигантские некротические очаги, а при закупорке терминальных ветвей — сегментарные некрозы небольшого размера. Морфологически при шоковой печени определяется острый центролобулярный некроз гепатоцитов, который не затрагивает субкапсулярные поля.
Симптомы инфаркта печени
Шоковая печень развивается преимущественно на фоне тяжелого основного заболевания, поэтому проявления некроза гепатоцитов отходят на второй план. Начальный признак гипоксического гепатита — внезапные тупые или тянущие боли в правом подреберье. При надавливании в этой области болезненность усиливается. Живот не вздут и не напряжен, при пальпации других отделов передней брюшной стенки неприятные ощущения не беспокоят.
Иногда ощущаются очень сильные боли, поэтому человек старается принять неподвижное положение, лежа на спине или на левом боку. Часто больные сообщают об иррадиации болевых ощущений в подключичную ямку, область плечевого сустава или межлопаточную зону. Для шоковой печени характерны признаки венозного застоя. Заметны отеки и пастозность голеней, набухание яремных вен.
Вследствие эндотоксемии появляются тошнота и многократная рвота, которая не приносит человеку облегчения. В рвотных массах присутствует примеси желчи, иногда — прожилки крови. При крупных очагах инфаркта температура тела повышается до 38-39°С. Желтушность кожных покровов отмечается очень редко, более типичен акроцианоз. Сопутствующее снижение перфузии головного мозга проявляется нарушениями сознания.
Осложнения
При массивной гибели гепатоцитов и наличии у пациента тяжелой основной патологии возникает молниеносная печеночная недостаточность. Состояние является прогностически неблагоприятным, в большинстве случаев в течение первой недели наблюдается летальный исход. При относительно небольшом объеме поражения характерно замещение органа соединительной тканью с развитием цирроза.
Инфаркт паренхимы зачастую осложняется бактериальной инфекцией, которая характеризуется генерализованным течением. Реже некротизированный участок отграничивается капсулой от окружающих тканей — формируется секвестр. При гипоксическом гепатите сохраняется высокий риск кровотечения. Если гипоксия вызвана местными сосудистыми нарушениями, существует вероятность инфаркта кишечника.
Диагностика
Поскольку инфаркт печени обычно обусловлен другой патологией, обследованием пациента занимается специалист соответствующего профиля совместно с гастроэнтерологом или хирургом. При физикальном осмотре патогномоничные признаки отсутствуют. Для ишемического гепатита типично резкое увеличение и болезненность печени, отрицательные перитонеальные симптомы. Обследование включает ряд лабораторных и инструментальных методов:
- Биохимические анализы. Печеночный инфаркт характеризуется резким повышением уровня трансаминаз (АЛС и АСТ) — в 100-200 раз по сравнению с нормой. В отличие от вирусных гепатитов при инфаркте резко возрастает уровень фермента ЛДГ. Наблюдается умеренное повышение билирубина и креатинина крови, а также резкое падение уровня протромбина.
- УЗИ органов брюшной полости. Ультразвуковое исследование визуализирует инфаркт в печеночной ткани как очаг низкой эхогенности, который имеет треугольную или неправильную форму. Ишемизированный участок располагается в периферической зоне органа, резко отграничен от интактной паренхимы. Для оценки печеночного кровотока используют допплерографию.
- Рентгенологические методы. Для уточнения размеров и локализации инфаркта рекомендована компьютерная томография брюшной полости. При затруднениях в диагностике выполняют суперселективную ангиографию, которая направлена на выявление окклюзии печеночных сосудов.
- Биопсия. Является факультативным исследованием и проводится при недостаточной информативности других диагностических методов. В биоптатах из зоны инфаркта обнаруживают умеренный некроз в центре печеночных долек без признаков воспаления. Визуализируются множественные мелкие кровоизлияния и дилатация синусоидов.
Лечение инфаркта печени
Консервативная терапия
Главная задача при лечении шоковой печени — устранение основной причины патологии. Консервативные мероприятия подбирают только в стационаре, большинство больных госпитализируют в отделение интенсивной терапии. Назначаются препараты из группы бета-адреномиметиков, которые увеличивают сердечный выброс и повышают доставку кислорода в печеночную паренхиму.
Дальнейшие действия включают коррекцию гомеостаза и лечение сопутствующих заболеваний:
- При кровопотере производят переливание коллоидных и кристаллоидных растворов, трансфузию компонентов крови.
- При сепсисе подбирают мощную антибактериальную терапию.
- При дыхательной недостаточности и выраженной гипоксии прибегают к кислородной поддержке или переводят пациента на ИВЛ.
Хирургическое лечение
При выявлении тромбозов печеночных сосудов проводятся малоинвазивные методики: селективная ангиография с тромболизисом или тромбэктомией. В случае эмболии артерии выполняется эмболэктомия и стентирование мелких артериальных ветвей. Если инфаркт этиологически связан со злокачественной опухолью, назначают радикальную полостную операцию — резекцию доли печени.
Прогноз и профилактика
При инфаркте печени прогноз в первую очередь определяется тяжестью основной патологии. При успешном восстановлении показателей гемодинамики и ликвидации первопричины наблюдается восстановления печеночных функций. Прогноз сомнителен для пациентов с хронической застойной сердечной недостаточностью или циррозом печени. Профилактические мероприятия направлены на устранение факторов риска ишемического гепатита.
Источник
Содержание:
Инфаркт миокарда (ИМ) – самая серьезная клиническая форма ишемии сердца. Это острое, угрожающее жизни, состояние, обусловленное относительным либо абсолютным недостатком кровоснабжения определенной части миокарда вследствие тромбоза коронарной артерии, в результате чего формируется очаг некроза, т.е. область с отмершими клетками – кардиомиоцитами.
Инфаркт сердца – одна из ведущих причин смертности населения планеты. Его развитие напрямую зависит от возраста и пола человека. В связи с более поздним появлением атеросклероза у женщин инфаркты диагностируются у них в 3–5 раз реже, чем у мужчин. В группу риска попадают все представители мужского пола, начиная с 40-летнего возраста. У людей обоих полов, перешедших рубеж 55–65 лет, заболеваемость примерно одинакова. По статистике 30–35% всех случаев острого инфаркта сердечной мышцы заканчиваются летальным исходом. До 20% внезапных смертей вызваны этой патологией.
Причины инфаркта
Главные причины развития ИМ:
- Атеросклероз сосудов сердца, в частности коронарных артерий. В 97% случаев атеросклеротическое поражение стенок сосудов приводит к развитию ишемии миокарда с критическим сужением просвета артерий и длительным нарушением кровоснабжения миокарда.
- Тромбоз сосудов, к примеру, при коронарите различного генеза.Полное прекращение кровоснабжениямышцы происходит вследствиеобтурации (закупорки) артерий или мелких сосудов атеросклеротической бляшкой или тромбом.
- Эмболия венечных артерий, например, при септическом эндокардите, реже заканчивается образованием некротического очага, тем не менее являясь одной из причин формирования острой ишемии миокарда.
Нередко встречается сочетание вышеперечисленных факторов: тромб закупоривает спастически суженный просвет артерии, пораженной атеросклерозом или формируется в области атеросклеротической бляшки, выпяченной из-за произошедшего кровоизлияния в ее основание.
- Пороки сердца. Коронарные артерии могут отходит от аорты вследствие формирования органического поражения сердца.
- Хирургическая обтурация. Механическое вскрытие артерии или ее перевязка во время проведения ангиопластики.
Факторы риска инфаркта миокарда:
- Пол (у мужчин чаще).
- Возраст (после 40–65 лет).
- Стенокардия.
- Порок сердца.
- Ожирение.
- Сильный стресс или физическое перенапряжение при имеющейся ИБС и атеросклерозе.
- Сахарный диабет.
- Дислипопротеинемия, чаще гиперлипопротеинемия.
- Курение и прием алкоголя.
- Гиподинамия.
- Артериальная гипертония.
- Ревмокардит, эндокардит или другие воспалительные поражения сердца.
- Аномалии развития коронарных сосудов.
Механизм развития инфаркта миокарда
Течение болезни делится на 5 периодов:
- Прединфарктный (стенокардия).
- Острейший (острая ишемия сосудов сердца).
- Острый (некробиоз с формированием некротической области).
- Подострый (стадия организации).
- Постинфарктный (образование рубца в месте некроза).
Последовательность патогенетических изменений:
- Нарушение целостности атеросклеротического отложения.
- Тромбоз сосуда.
- Рефлекторный спазм поврежденного сосуда.
При атеросклерозе избыточный холестерин откладывается на стенках сосудов сердца, на которых образуются липидные бляшки. Они сужают просвет пораженного сосуда, замедляя кровоток по нему. Различные провоцирующие факторы, будь то гипертонический криз или эмоциональное перенапряжение, приводят к разрыву атеросклеротического отложения и повреждению сосудистой стенки. Нарушение целостности внутреннего слоя артерии активирует защитный механизм в виде свертывающей системы организма. К месту разрыва прилипают тромбоциты, из которых формируется тромб, закупоривающий просвет сосуда. Тромбоз сопровождается выработкой веществ, приводящих к спазмированию сосуда в области повреждения либо по всей его длине.
Клиническое значение имеет сужение артерии на 70% размера ее диаметра, при этом просвет спазмируется до такой степени, что кровоснабжение не может быть компенсировано. Это возникает вследствие атеросклеротических отложений на стенки сосудов и ангиоспазма. В результате нарушается гемодинамика области мышцы, получающей кровь через поврежденное сосудистое русло. При некробиозе страдают кардиомиоциты, недополучая кислород и питательные вещества. Нарушается метаболизм и функционирование сердечной мышцы, ее клетки начинают отмирать. Период некробиоза длится до 7 часов. При незамедлительно оказанной в этот промежуток времени медицинской помощи происходящие изменения в мышце могут быть обратимы.
При формировании некроза в пораженной области восстановить клетки и повернуть процесс вспять невозможно, повреждения приобретают необратимый характер. Страдает сократительная функция миокарда, т.к. некротизированная ткань не участвует в сокращении сердца. Чем обширнее область поражения, тем сильнее снижается сократимость миокарда.
Единичные кардиомиоциты или небольшие их группы гибнут спустя примерно 12 часов от начала острого заболевания. Через сутки микроскопически подтверждается массовое омертвление клеток сердца в зоне поражения. Замещение области некроза соединительной тканью начинается через 7–14 дней от начала инфаркта. Постинфарктный период продолжается 1,5–2 месяца, в течение которых окончательно формируется рубец.
Передняя стенка левого желудочка – наиболее частое место локализации некротической зоны, поэтому в большинстве случаев выявляется трансмуральный ИМ именно этой стенки. Реже поражается верхушечная область, задняя стенка или межжелудочковая перегородка. Инфаркты правого желудочка в кардиологической практике встречаются редко.
Классификация инфаркта миокарда
Относительно размера поражения ткани инфаркт миокарда бывает:
- Мелкоочаговый. Формируется один или несколько маленьких по размеру некротических участков. Диагностируется в 20% случаев от общего числа инфарктников. У 30% пациентов мелкоочаговый инфаркт трансформируется в крупноочаговый.
- Крупноочаговый (чаще трансмуральный). Образуется обширная область некроза.
По глубине некротического поражения различают:
- Трансмуральный. Некротическая область охватывает всю толщу миокарда.
- Субэпикардиальный. Участок с отмершими кардиомиоцитами прилегает к эпикарду.
- Субэндокардиальный. Некроз сердечной мышца в районе прилегания к эндокарду.
- Интрамуральный. Участок некроза находится в толще левого желудочка, но не доходит до эпикарда или эндокарда.
В зависимости от кратности возникновения:
- Первичный. Возникает первый раз.
- Повторный. Развивается через 2 месяца или позже после начала первичного.
- Рецидивирующий. Появляется на стадии формирования рубцовой ткани первичного инфаркта, т.е. в течение первых 2 мес. от первичного острого поражения миокарда.
Относительно локализации процесса:
- Левожелудочковый.
- Правожелудочковый.
- Септальный, или инфаркт межжелудочковой перегородки.
- Сочетанный, к примеру переднебоковой ИМ.
Отталкиваясь от электрокардиологических изменений, фиксируемых на кардиограмме:
- Q-инфаркт. Электрокардиограмма фиксирует сформировавшийся патологический з. Q или желудочковый комплекс QS. Изменения характерны для крупноочаговых ИМ.
- Не Q-инфаркт с инверсией з. Т и без патологии з. Q. Чаще встречается при мелкоочаговых инфарктах.
В зависимости от развития осложнений:
- Неосложненный.
- Осложненный.
Формы острого ИМ, относительно наличия и места расположения болей:
- Типичная. Боль сосредоточена в прекардиальной либо загрудинной области.
- Атипичная. Форма заболевания с атипичной локализацией болей:
Периоды заболевания:
- Острейший.
- Острый.
- Подострый.
- Постинфарктный.
Симптомы инфаркта миокарда
Интенсивность и характер болевых ощущений зависят от нескольких факторов: размера и локализации некротического очага, а также стадии и формы инфаркта. У каждого пациента клинические проявления различны в силу индивидуальных особенностей и состояния сосудистой системы.
Признаки типичной формы инфаркта миокарда
Яркая клиническая картина с типичным и выраженным болевым синдромом наблюдается при крупноочаговом (трансмуральном) инфаркте сердца. Течение болезни разделяю на определенные периоды:
- Прединфарктный, или продромальный период. У 43–45% инфарктников этот период отсутствует, т.к. болезнь начинается внезапно. Большинство пациентов перед инфарктом отмечают учащение приступов стенокардии, загрудинные боли становятся интенсивными и продолжительными. Изменяется общее состояние – снижается настроение, появляется разбитость и страх. Эффективность антиангинальных средств значительно снижается.
- Острейший период (от 30 мин до нескольких часов). При типичной форме острый инфаркт сопровождается нестерпимой загрудинной болью с иррадиацией в левую сторону туловища – руку, нижнюю челюсть, ключицу, предплечье, плечо, область между лопатками. Редко под лопатку или левое бедро. Боли могут быть жгучими, режущими, давящими. Некоторые ощущают распирание в груди или ломоту. В течение нескольких минут боль достигает своего максимума, после чего сохраняется до часа и дольше, то усиливаясь, то ослабевая.
- Острый период (до 2 суток, при рецидивирующем течении до 10 дней и дольше). У подавляющего большинства больных ангинозная боль проходит. Ее сохранение свидетельствует о присоединении эпистеноперикардиального перикардита либо о продолжительном течении ИМ. Нарушения проводимости и ритма сохраняются, также как и артериальная гипотензия.
- Подострый период (длительность – 1 мес). Общее состояние пациентов улучшается: температура нормализуется, проходит одышка. Полностью или частично восстанавливается сердечный ритм, проводимость, звучность тонов, но блокада сердца регрессу не поддается.
- Постинфарктный период – завершающий этап течения острого ИМ, длящийся до 6 месяцев. Некротическая ткань окончательно заменяется плотным рубцом. Сердечная недостаточность устраняется за счет компенсаторной гипертрофии сохранившегося миокарда, но при обширной площади поражения полная компенсация невозможна. В этом случае проявления сердечной недостаточности прогрессируют.
Начало боли сопровождается сильной слабостью, появлением обильного липкого (профузного) пота, чувством страха смерти, учащением сердцебиения. При физикальном обследовании выявляется бледность кожи, липкий пот, тахикардия и другие нарушения ритма (экстрасистолия, фибрилляция предсердий), возбуждение, одышка в покое. В первые минуты повышается артериальное давление, потом резко понижается, что свидетельствует о развивающейся недостаточности сердца и кардиогенном шоке.
При тяжелом течении развивается отек легких, иногда сердечная астма. Тоны сердца при аускультации приглушены. Появление ритма галопа говорит о левожелудочковой недостаточности, от степени выраженности которой зависит аускультативная картина легких. Жесткое дыхание, хрипы (влажные) подтверждают застой крови в легких.
Ангинозная боль в этом периоде нитратами не купируется.
В результате перифокального воспаления и некроза появляется лихорадка, сохраняющаяся на протяжении всего периода. Температура поднимается до 38,50 С, высота ее подъема зависит от размера некротического очага.
При мелкоочаговом инфаркте мышцы сердца симптоматика менее выражена, течение болезни не такое четкое. Редко развивается недостаточность сердца. Аритмия выражается в умеренной тахикардии, которая бывает не у всех больных.
Признаки атипичных форм инфаркта миокарда
Подобные формы характеризуются нетипичной локализацией болей, затрудняющей своевременную установку диагноза.
- Астматическая форма. Характерен кашель, приступы удушья, проливной холодный пот.
- Гастралгическая (абдоминальная) форма проявляется болями в эпигастральной области, рвотой, тошнотой.
- Отечная форма бывает при массивной очаге некроза, приводящем к тотальной сердечной недостаточности с отеками, одышкой.
- Церебральная форма характерна для пожилых пациентов с выраженным атеросклерозом не только сердечных, но и мозговых сосудов. Проявляется клиникой ишемии головного мозга с головокружениями, потерей сознания, шумом в ушах.
- Аритмическая форма. Единственным ее признаком может быть пароксизмальная тахикардия.
- Стертая форма отличается отсутствием жалоб.
- Периферическая форма. Боли могут быть только в руке, подвздошной ямке, нижней челюсти, под лопаткой. Иногда опоясывающая боль схожа с болями, возникающими при межреберной невралгии.
Осложнения и последствия инфаркта миокарда
- Тромбоз в желудочках.
- Острый эрозивный гастрит.
- Острый панкреатит либо колит.
- Парез кишечника.
- Желудочное кровотечение.
- Синдром Дресслера.
- Острая, а в дальнейшем хроническая прогрессирующая недостаточность сердца.
- Кардиогенный шок.
- Постинфарктный синдром.
- Эпистенокардиальный перикардит.
- Тромбоэмболии.
- Аневризма сердца.
- Отек легких.
- Разрыв сердца, приводящий к его тампонаде.
- Аритмии: пароксизмальная тахикардия, экстрасистолия, внутрижелудочковая блокада, фибрилляция желудочков и другие.
- Инфаркт легких.
- Пристеночный тромбоэндокардит.
- Психические и нервные расстройства.
Диагностика инфаркта миокарда
Анамнез болезни, электрокардиографические признаки (изменения на ЭКГ) и характерные сдвиги ферментативной активности в сыворотке крови являются основным критериями при диагностике острого ИМ.
Лабораторная диагностика
В первые 6 часов острого состояния в крови выявляется повышенный уровень белка – миоглобина, участвующего в транспортировке кислорода внутрь кардиомиоцитов. В течение 8–10 часов больше чем на 50% увеличивается креатинфосфокиназа, показатели активности которой нормализуются к концу 2 суток. Этот анализ повторяют каждые 8 часов. Если получают троекратный отрицательный результат, то инфаркт сердца не подтверждается.
На более позднем сроке необходим анализ на определение уровня лактатдегидрогеназы (ЛДГ). Активность этого фермента увеличивается спустя 1–2 суток от начала массового омертвления кардиомиоцитов, по прошествии 1–2 недель приходит в норму. Высокой специфичностью отличается повышение изоформ тропонина, увеличение уровня аминотрансфераз (АСТ, АЛТ). В общем анализе – повышение СОЭ, лейкоцитоз.
Инструментальная диагностика
ЭКГ фиксирует появление отрицательного з. Т либо его двухфазность в определенных отведениях (при мелкоочаговом ИМ), патологии комплекса QRS или з. Q (при крупноочаговом ИМ), а также различные нарушения проводимости, аритмии.
Электрокардиография помогает определить обширность и локализацию области омертвения, оценить сократительную способность сердечной мышцы, выявить осложнения. Рентгенологическое исследование малоинформативно. На поздних этапах проводят коронарографию, выявляющую место, степень сужения или непроходимости коронарной артерии.
Лечение инфаркта миокарда
При подозрении на инфаркт сердца срочно вызывают скорую помощь. До приезда медиков нужно помочь больному принять полусидячее положение с согнутыми в коленях ногами, ослабить галстук, расстегнуть одежду, чтобы она не стягивала грудь и шею. Открыть форточку или окно для доступа свежего воздуха. Под язык положить таблетку аспирина и нитроглицерина, которые предварительно измельчить или попросить больного их разжевать. Это необходимо для более быстрого всасывания действующего вещества и получения скорейшего эффекта. Если ангинозные боли не прошли от одной таблетки нитроглицерина, то его следует рассасывать через каждые 5 минут, но не больше 3 таблеток.
Больной с подозрением на инфаркт сердца подлежит незамедлительной госпитализации в кардиологическую реанимацию. Чем раньше реаниматологи начнут лечение, тем благоприятнее дальнейший прогноз: можно предупредить развитие ИМ, предотвратить появление осложнений, сократить площадь очага некроза.
Основные цели первоочередных лечебных мероприятий:
- снятие болевого синдрома;
- ограничение некротической зоны;
- предотвращение осложнений.
Купирование болевых ощущений – один из важнейших и неотложных этапов лечения ИМ. При неэффективности таблетированного нитроглицерина, его вводят в/в капельно либо наркотический анальгетик (например, морфин) + атропин в/в. В некоторых случаях проводят нейролептанальгезию – в/в нейролептик (дроперидол) + анальгетик (фентанил).
Тромболитическая и антикоагулянтная терапия направлена на сокращение зоны некроза. Впервые сутки от появления первых признаков инфаркта для рассасывания тромба и восстановления кровотока возможно проведение процедуры тромболизиса, но для предотвращения гибели кардиомиоцитов эффективнее ее делать в первые 1–3 часа. Назначают тромболитические препараты – фибринолитики (стрептокиназа, стрептаза), антиагреганты (тромбо-АСС), антикоагулянты (гепарин, варфарин).
Антиаритмическая терапия. Для устранения нарушений ритма, сердечной недостаточности, восстановления метаболизма в ткани сердца применяют антиаритмические препараты (бисопролол, лидокаин, верапамил, атенолол), анаболики (ретаболил), поляризующую смесь и т.д.
Для лечения острой недостаточности сердца используют сердечные гликозиды (коргликон, строфантин), диуретики (фуросемид).
Для устранения психомоторного возбуждения применяют нейролептики, транквилизаторы (седуксен), седативные средства.
Прогноз заболевания зависит от быстроты оказания первой квалифицированной помощи, своевременности проведения реанимационных мероприятий, размера и локализации очага поражения миокарда, наличия либо отсутствия осложнений, возраста пациента и имеющихся у него сопутствующих сердечно-сосудистых патологий.
Источник
