Инфаркт миокарда при артериальной гипертензии

В большинстве случаев артериальная гипертензия и инфаркт миокарда тесно взаимосвязаны. Оба заболевания поражают сердечно-сосудистую систему. Гипертония в стадии декомпенсации приводит к тяжелым осложнениям, отражающимся на состоянии мозга, сердца и почек. Это обусловлено патофизиологией гемодинамики. Предынфарктное состояние является прямым последствием стойкого повышения АД. Диагностика сердечно-сосудистых патологий проводится с помощью лабораторных и инструментальных методов. Лечение обязательно включает прием гипотензивных препаратов и пожизненный контроль цифр артериального давления.

Артериальная гипертензия и инфаркт миокарда: основная взаимосвязь
При высоком АД меняется гемодинамика. Нагрузка на сердце повышается, оно начинает работать на износ. При этом страдают коронарные сосуды, кровоснабжающие сердечную мышцу. Когда на фоне гипертонии развивается атеросклероз, а бляшки закупоривают сосудистый просвет, количество крови, проходящее через него, снижается. Развивается кислородное голодание миокарда. Если ишемия длительная или перекрыто кровоснабжение большого участка сердечной мышцы, возникает инфаркт.
Инфарктное состояние является крайней степенью ишемической болезни, возникающей на фоне артериальной гипертонии. При нем происходит некроз участка миокарда.
Вернуться к оглавлению
Причины инфаркта при гипертензии
К ним относятся:
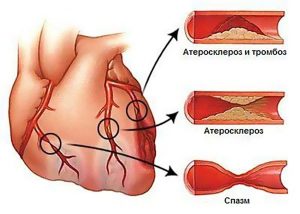 Спазм сосудов, атеросклероз, тромбоз часто приводят к серьезной патологии.
Спазм сосудов, атеросклероз, тромбоз часто приводят к серьезной патологии.
- Нарушение реологии крови. Когда на фоне высоких цифр систолического и диастолического артериального давления меняется гемодинамика, возникает недостаток кровоснабжения сердечной мышцы.
- Ишемия. При дефиците кровоснабжения миокарда через коронарные сосуды возникает его кислородное голодание.
- Атеросклероз. Образование атеросклеротических бляшек в сосудистом русле всегда сопровождает гипертонию.
- Рефлекторные спазмы. Высокое давление приводит к спазмированию сосудов, уменьшению их просвета и резкому нарушению кровоснабжения сердца.
Вернуться к оглавлению
Механизм развития
При гипертонии наблюдаются изменения во всех органах и системах. Она затрагивает головной мозг, кровеносное русло, почки и сердце. Сердечная мышца, выполняя функцию насоса, вынуждена с удвоенной силой нагнетать кровь в большой и малый круги кровообращения. Орган постепенно изнашивается. К этому добавляется, развившаяся на фоне гипертензии, коронарная недостаточность. Хроническая ишемия и постоянные скачки давления приводят к острому нарушению кровоснабжение миокарда и развитию его некроза. Этим термином медики обозначают отмирание определенного участка сердечной мышцы с выпадением ее функции.
Вернуться к оглавлению
Симптомы коронарного синдрома
Для инфаркта характерна такая клиническая симптоматика:
 Клиническим симптомом при патологическом состоянии является повышенное выделение липкого, холодного пота.
Клиническим симптомом при патологическом состоянии является повышенное выделение липкого, холодного пота.
- Внезапная боль за грудиной. Она похожа на стенокардию и иррадирует в шею, спину, правую или левую руку и челюсть. Болезненные ощущения носят приступообразный характер.
- Гипергидроз. У пациента появляется повышенная потливость. Пот холодный, липкий.
- Страх смерти. Это естественная реакция на нарушение гемодинамики, когда мозг недополучает достаточное количество кислорода, человек впадает в панику.
- Отсутствие купирования симптомов при приеме «Нитроглицерина».
- Специфическая поза. Пациент пытается сесть, опираясь на руки, и немного наклоняет туловище вперед. Так ему легче дышать.
- Синюшность кончиков пальцев и носогубного треугольника. При нарушениях кровообращения возникает цианоз этих участков.
- Потеря сознания. Если некрозом охвачен обширный участок сердечной мышцы, человек способен впадать в беспамятство.
Вернуться к оглавлению
Диагностические мероприятия
Для диагностики болезни проводятся такие лабораторные и инструментальные методики обследования:
- Общий анализ крови. Его данные показывают повышение количества лейкоцитов и скорости оседания эритроцитов.
- Биохимия крови. На анализе отмечается повышение трансаминаз, а именно аланинаминотрансферазы и аспартатаминотрансферазы. Рост концентрации ферментов свидетельствует о некрозе.
- Определение уровня креатинфосфокиназы. Этот специфический анализ является «золотым стандартом» при инфарктах.
- Электрокардиография. На электрокардиограмме при положительном диагнозе будут отмечаться специфические комплексы со смещением сегмента ST.
- Эхокардиография. На экране видно нарушение деятельности сердца, отображенное в ультразвуковом режиме.
- Тонометрия. При ней отмечаются сниженные цифры систолического и диастолического артериального давления вследствие недостаточной насосной функции миокарда.
Вернуться к оглавлению
Лечение патологии и дальнейшее ведение пациентов
С лечебной целью применяется медикаментозная терапия и коррекция образа жизни больных, перенесших инфаркт. Им рекомендуется прием антикоагулянтов, антиагрегантов и тромболитиков. Эти препараты уничтожают образовавшиеся в коронарных сосудах тромбы и предотвращают формирование новых. Пациенту выписывают диуретики. Эти мочегонные лекарства помогают выводить из организма лишнюю воду, чем снижают нагрузку на сердце. В схему лечения обязательно включают гипотензивные препараты. Среди них предпочтение отдают комбинированным формам бета-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента и блокаторам кальциевых каналов. Рекомендации по изменению образа жизни включают диетическое питание и умеренную физическую активность.
Источник
В структуре причин смерти от сердечно-сосудистых заболеваний в Украине ишемическая болезнь сердца (ИБС) составляет 60 %, причем более половины случаев смерти вызваны постинфарктным кардиосклерозом [6]. Достаточно убедительно обосновано отрицательное влияние артериальной гипертензии (АГ) на течение ИБС [4, 18]. Результаты многоцентровых исследований показали, что современное лечение АГ приводит к достоверному снижению частоты развития коронарных событий, однако только у лиц, не имеющих ИБС [11]. Инфаркт миокарда (ИМ), являющийся одной из наиболее тяжелых форм течения ИБС, формирующий развитие постинфарктного кардиосклероза, в 50–70 % случаев сопровождается наличием АГ. В связи с этим целесообразно определить значение АГ в формировании постинфарктного кардиосклероза, в оценке дальнейшего течения ИБС и уровня функционального восстановления больных, перенесших ИМ.
Цель работы – изучить влияние артериальной гипертензии на некоторые клинико-функциональные параметры, обусловливающие уровень восстановления работоспособности у больных, перенесших инфаркт миокарда.
Материал и методы
В обследование включено 170 больных, перенесших ИМ. Исследования проводили на 7–8-й день развития коронарной катастрофы и на 3–6-м месяце течения заболевания. У 139 больных наблюдали АГ II степени, гипертоническую болезнь II–III стадии. Группы риска течения ИБС определяли после окончания острого периода ИМ [2]. Больным с высоким уровнем риска и АГ (n=79) провели операцию аортокоронарного шунтирования (АКШ) в течение первого полугодия от развития ИМ. Группу сравнения (n=31) составили больные с высоким риском без АГ после операции АКШ.
Больные группы среднего риска (n=60) проходили реабилитацию в кардиологическом санатории “Украина” (Ворзель). Наблюдение за пациентами этой группы заканчивали через 3 мес с момента развития ИМ.
Все больные получали фармакологическое лечение ИМ и АГ с включением нитратов, b-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента (АПФ), часть больных – с применением антагонистов кальция и диуретиков. Из 60 пациентов группы среднего риска тромболитическую терапию провели 12 (20 %), у 7 из 12 больных после коронароангиографии (КАГ) было выполнено ургентное стентирование венечных артерий. У 79 больных группы высокого риска до операции АКШ была выполнена КАГ, а у 24 из них исследовали кровь из коронарного синуса для определения содержания эндотелина-1 (радиоиммунный метод с использованием систем “Endothelin-1” (“Amersham Bioscienses”, Англия). У 12 здоровых и 44 больных в острый период ИМ определяли содержание альдостерона в периферической крови (радиоиммунный метод с использованием наборов фирмы “Immunotech”, Франция). У всех пациентов проводили эхокардиографию, у 60 больных – суточное мониторирование артериального давления (АД), у 75 больных – нагрузочное тестирование на велоэргометре.
Суточное мониторирование АД проводили с помощью аппарата “АВРМ-04” (“Meditech”, Венгрия). Монитор активировался по стандартному протоколу каждые 15 мин в дневное время (06.00–22.00) и каждые 30 мин в ночное время (22.00–06.00). Показатели анализировали с использованием программного обеспечения данного аппарата. Рассчитывали показатели суточного мониторирования АД: среднесуточное, среднедневное, ночное систолическое (САД) и диастолическое (ДАД) АД, частоту сокращений сердца (ЧСС), индексы вариабельности (стандартное отклонение) САД и ДАД, индекс времени САД, ДАД и ЧСС, индекс нагрузки давлением (индекс площади) – для САД и ДАД.
Согласно рекомендациям Ассоциации кардиологов Украины (2004) в качестве нормы приняты следующие показатели: среднесуточное АД – не выше 125/80 мм рт. ст., индекс времени для САД – меньше 20 %, для ДАД – меньше 15 %, суточный индекс – 10–20 %, дневная вариабельность САД – не выше 15 мм рт. ст., а ДАД – 14 мм рт. ст., ночная вариабельность САД – 15 мм рт. ст., а ДАД – 12 мм рт. ст.
Эхокардиографическое исследование проводили на ультразвуковом сканере “Medison SAA-9900” (Южная Корея). Оценивали следующие параметры эхокардиографии: конечнодиастолический (КДР) и конечносистолический (КСР) размеры левого желудочка (ЛЖ), конечнодиастолический (КДО), конечносистолический (КСО) и ударный (УО) объемы ЛЖ, фракцию выброса (ФВ) ЛЖ, массу миокарда (ММ) ЛЖ, размеры левого предсердия, правого желудочка, а также толщину задней стенки (ТЗС) ЛЖ и межжелудочковой перегородки (ТМЖП) в диастолу. Индекс ММ (ИММ) ЛЖ вычисляли по формуле:
ИММ ЛЖ = ММ ЛЖ / ППТ,
где ППТ – площадь поверхности тела.
Определяли также отношение КСО к УО. Гипертрофию ЛЖ фиксировали при ИММ больше 125 г/м2 у мужчин и 110 г/м2 – у женщин. Тип ремоделирования ЛЖ классифицировали согласно рекомендациям A. Ganau с выделением дилатационного типа по D. Savage и Е.В. Шляхто [7, 12, 16]. Физическую нагрузку оценивали в результате пробы на велоэргометре на 7–8-й неделе от момента развития ИМ, в оперированной группе – через 3–6 мес после операции АКШ.
Статистическую обработку материалов проводили с помощью пакета статистических программ “Statistica for Windows” с использованием t-критерия Стьюдента.
Результаты и их обсуждение
У больных с АГ с высоким риском, перенесших ИМ, более часто по данным КАГ выявляли поражение нескольких сосудов. Так, в группе прооперированных больных поражение трех и более сосудов наблюдали у 66 (77,2 %) из 79 пациентов по сравнению с 17 (54,8 %) из 31 – у больных без АГ. При этом у больных с АГ, перенесших ИМ, чаще отмечали сочетание нескольких видов поражения венечного русла.
Известно, что синтез эндотелина-1 во многом определяет дисфункцию эндотелия, являющуюся пусковым механизмом в патогенезе сердечно-сосудистой патологии (атеросклероз, АГ, тромбообразование), и значительно опережает появление клинических признаков заболевания [5].
Эндотелин-1 является мощным и длительно действующим сосудистым констриктором с эффективностью, на порядок превышающей вазоконстрикторный потенциал ангиотензина II (A II) [15], за что справедливо получил характеристику “мощнейшего из всех известных короткоживущих, но длительно действующих медиаторов” [14].
Кардиальные эффекты эндотелина-1 (вазоконстрикция и ишемия) реализуются через рецепторный аппарат (рецепторы субтипа А), локализованный в основном в гладкой мускулатуре венечных артерий. Определенное количество рецепторов, чувствительных к эндотелину-1, обнаружено на мембранах кардиомиоцитов, а их количество увеличивается одновременно с повышением уровня эндотелина-1 в крови в условиях экспериментального и клинического ИМ [9], что дает основание предполагать непосредственное влияние пептида на миокард.
Повышение содержания эндотелина-1 в периферической крови отмечено при остром ИМ и сердечной недостаточности [1, 3]. Концентрация иммунореактивного эндотелина-1 значительно повышена у пациентов с гипертонической болезнью II–III стадии и симптоматической АГ [19, 20].
В ряде исследований установлено, что повышение синтеза пептида непосредственно связано с активацией ренин-ангиотензиновой (РАС) и симпатоадреналовой систем. В наших предыдущих работах установлена активация миокардиальной РАС у больных с острым ИМ, особенно на фоне АГ [8]. Имеются данные о преимущественно локальной продукции эндотелина-1 при сердечной недостаточности и нарушении сердечного ритма [13, 19].
Таким образом, можно предположить, что эндотелин-1 является не только маркером и выразителем вазоконстрикции венечных сосудов и ИБС, но и обладает определенным повреждающим эффектом на сердечную мышцу непосредственно и/или через активацию миокардиальной РАС. В связи с этим наиболее информативным является определение содержания пептида в образцах крови, оттекающей непосредственно от сердца, то есть из коронарного синуса.
Выявлена зависимость между увеличением содержания эндотелина-1 и наличием АГ при поражении трех сосудов, что сочетается с результатами КАГ. С увеличением количества пораженных сосудов до 4–5 повышается содержание эндотелина-1 практически во всех группах, и наиболее выражено в группе с АГ.
Анализ данных о содержании альдостерона в крови больных, перенесших ИМ, позволил установить зависимость уровня альдостерона от локализации поражения миокарда и наличия у больных АГ. У больных с передне-перегородочно-верхушечной локализацией ИМ без АГ отмечено увеличение концентрации альдостерона в крови, которое не достигает статистической значимости вследствие значительных индивидуальных колебаний; у больных с нижне-боковой локализацией ИМ без АГ уровень альдостерона в крови находился в пределах нормы. Уровень альдостерона в крови больных с АГ значительно превышает таковой в контрольной группе независимо от локализации поражения. Наиболее выраженное увеличение концентрации альдостерона в крови отмечено у больных с передне-перегородочно-верхушечной локализацией ИМ на фоне АГ.
Почему у больных с АГ при лечении антигипертензивными препаратами, в первую очередь ингибиторами АПФ, сохраняется повышенный уровень альдостерона? Как известно, А II является одним из основных стимуляторов синтеза альдостерона. На определенном этапе приема ингибиторов АПФ наблюдается не только возврат концентрации альдостерона к исходному уровню, но и его повышение. Этот феномен связан с эффектом “ускользания”, когда при длительном приеме препаратов этого класса активируется “нерениновый” шунт синтеза A II с возобновлением его влияния на синтез альдостерона. Существенное влияние на функцию РАС оказывает и повышенный локальный синтез эндотелина-1.
Гибель части кардиомиоцитов после острого ИМ является инициирующим механизмом активации миокардиальной РАС, что приводит к повышенному образованию А II и альдостерона, который стимулирует образование коллагена и фиброзной ткани в миокарде с дальнейшим ремоделированием ЛЖ [10]. По-видимому, этим объясняется дилатация полости ЛЖ у больных с повышенным содержанием альдостерона. Так, у пациентов с нормальными объемами ЛЖ (КДО – (134,7±20,7) мл, КСО – (65,3±6,2) мл) содержание альдостерона в периферической крови не превышало нормальные величины и составило (68,5±2,32) пг/мл, в группе же больных с дилатацией полости ЛЖ (КДО – (272,4±19,9) мл, КСО – (165,8±5,7) мл) уровень гормона достоверно превышал таковой у больных с сохраненными объемами ЛЖ – (182,7±7,3) пг/мл.
Таким образом, наши данные свидетельствуют об активации определенных патогенетически значимых звеньев нейрогуморальной регуляции, участвующих не только в развитии АГ у больных, перенесших ИМ, но и оказывающих повреждающее действие на миокард и сосуды.
Согласно результатам суточного мониторирования АД, у 2/3 больных со средним риском течения ИБС удается оптимизировать АД на уровне среднесуточных показателей в соответствии с рекомендуемыми величинами. Наибольшую информативность имел индекс времени, рекомендуемое же соотношение между дневным и ночным АД не достигалось, у большинства больных сохранялся суточный профиль АД “non-dipper”.
Наихудшие результаты по нормализации АД отмечены при наличии ремоделирования ЛЖ (гипертрофии ЛЖ с увеличением ТМЖП, ТЗС и ИММ ЛЖ). Почти у всех больных с АГ наблюдали диастолическую дисфункцию, преимущественно по гипертрофическому типу.
С целью определения значения оптимизации АД для выполнения физической нагрузки пробу с дозированной физической нагрузкой проводили на фоне оптимизации среднесуточного АД на уровне нижнего нормального. Однако при этом у 1/4 больных через 2 мес с момента развития ИМ не был достигнут уровень, достаточный для восстановления работоспособности для выполнения легкой работы. Установлено, что наибольшая потребность в кислороде на единицу работы была в группе больных с низкой переносимостью физической нагрузки.
Установлена определенная связь между уровнем функционального восстановления и состоянием сократительной функции миокарда. Так, при сохраненной ФВ ЛЖ для низкого уровня восстановления имели значение признаки ремоделирования ЛЖ (гипертрофия и дилатация), достоверно больший ИММ ЛЖ, наличие нарушений кинеза миокарда
Для того чтобы оценить состояние коронарного резерва, нами была проведена проба с дозированной физической нагрузкой 15 больным, у которых после реваскуляризации с помощью операции АКШ был достигнут уровень I функционального класса (ФК). Эти лица выполнили на велоэргометре свою возрастную норму без признаков ишемизации миокарда, однако снижение экономичности выполнения физической нагрузки при наличии АГ у них сохранялось, о чем свидетельствовало большое повышение САД на одинаковом пороговом уровне.
Следовательно, наличие АГ, даже при оптимизации среднего уровня АД до рекомендуемых низких нормальных величин, снижает восстановление работоспособности после ИМ, не обязательно обусловленное различием в состоянии коронарного резерва, а зависит от менее выгодного энергетического режима работы при АГ. Наличие АГ у больных со значительным нарушением кинеза миокарда, наличием гипертрофии и дисфункции ЛЖ является дополнительным показанием к проведению коронароангиографии с целью выяснения причин низкой переносимости физической нагрузки после ИМ.
Выводы
Артериальная гипертензия оказывает влияние на течение ишемической болезни сердца у больных, перенесших инфаркт миокарда, за счет увеличения морфологического поражения венечных сосудов, усугубления эндотелиальной дисфункции и повышения продукции альдостерона.
Снижение экономичности работы с большей потребностью миокарда в кислороде при артериальной гипертензии происходит даже при оптимизированном артериальном давлении, что должно учитываться при оценке восстановления работоспособности.
На основании адекватного выполнения физической нагрузки выше уровня III функционального класса у 75 % больных со средним уровнем риска течения ишемической болезни сердца через 2 мес после перенесенного инфаркта миокарда с артериальной гипертензией может быть рекомендован возврат к труду.
Литература
1.Алмазов В.А., Беркович О.А., Ситникова М.Ю. и др. Эндотелиальная дисфункция у больных с дебютом ишемической болезни в разном возрасте // Кардиология. – 2001. – № 5. – С. 26-29.
2.Амосова Е.Н. Рекомендации Европейскогоо общества кардиологов по диагностике и лечению стабильной стенокардии: что нового? // Терапия. – 2006. – № 11. – С. 12.
3.Князькова И.И., Цыганков А.И., Далашзаде С.Р. Влияние каптоприла на изменение эндотелиальных факторов у больных с острым инфарктом миокарда // Укр. кардіол. журн. – 2004. – № 7. – С. 34-38.
4.Лечение артериальной гипертензии в особых клинических ситуациях / Под ред. В.Н. Коваленко, Е.П. Свищенко. – Каменец-Подольский, 2005. – 500 с.
5.Полонецкий Л.З., Лаканько Л.Н., Полонецкий С.Л. и др. Реографическая оценка вазомоторной функции эндотелия плечевой артерии у больных ишемической болезнью сердца // Кардиология СНГ. – 2003. – № 1 (Приложение). – С. 129-130.
6.Сучасний стан здоров’я народу та напрямки його покращання в Україні (Аналітично-статистичний посібник). – К., 2005. – С. 9.
7.Шляхто Е.В., Конради А.О., Захаров Д.В., Рудоманов О.Г. Структурно-функциональное изменение миокарда у больных гипертонической болезнью // Кардиология. – 1999. – № 2. – С. 49-55.
8.Яновский Г.В., Савицкий С.Ю., Мойбенко М.А. Секреторная активность гипертрофированного миокарда и коронарный резерв у пациентов с ишемической болезнью сердца // Укр. кардіол. журн. – 2002. – № 1. – С. 17-20.
9.Battistelli S., Billi M., Manasse G. et al. Behavior of circulating endothelin-1 in a group of patients with acute myocardial infarction // Angiology. – 1995. – Vol. 50. – P. 629-638.
10.Delcayre C., Swynghedou B. Molecular mechanisms of myocardial remodeling. The role of aldosterone // J. Moll. Cell. Cardiol. – 2002. – Vol. 34. – P. 1577-1584.
11.European trial on reduction of cardiac events with perindopril in stable coronary arthery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary arthery disease: randomized, double-blind placebo-controlled multicentre trials (the EUROPA study) // Lancet. – 2003. – Vol. 362. – P. 782-788.
12.Ganau A., Devereux R.V., Roman M.J. et al. Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension // J. Amer. Coll. Cardiology. – 1992. – Vol. 19. – P. 1550-1558.
13.Horio J. Heart failure and circulatory peptides // Nippon Naika Gakkai Zasshi. – 2005. – Vol. 94. – P. 201-207.
14.Lucher T.F. Endothelin in the control of vascular tone and growth: role of local mediators and mechanical forces // Blood Pres. – 1994. – Supp l. – P. 18-22.
15.Randall M. Vascular activities of endothelins // Pharmacol. Therapy. – 1991. – Vol. 50. – P. 73-93.
16.Savage D.D., Garrison M.S., Kannel W.B. et al. The spectum of left ventricular hypertrophy in a general population sample Framingam Study // Circulation. – 1987. – Vol. 75. – P. 1-33.
17.Schiffrin E.L., Thribault G. Plasma endothelin in human essential hypertension // Amer. J. Hypertension. – 1991. – Vol. 4. – P. 303-308.
18.Solberg L.A. International atherosclerotic project // Nord Med. – 1970. – Vol. 83. – P. 97-102.
19.Stangl R., Dschietzig T., Richer C. et al. Pulmonary release and coronary and peripheral consumption of big endotehelin and endothelin-1 in severe heart failure: acute effects of vasodilatator therapy // Circulation. – 2000. – Vol. 102. – P. 1132-1138.
20.Yokokawa K., Tahara H., Kohno M. et al. Hypertension associated with endotelin-secreted malignant hemangioendothelioma // Ann. Intern. Med. – 1991. – Vol. 114. – P. 213-215.
И.К. Следзевская, Л.Н. Бабий, С.Ю. Савицкий, Н.П. Строганова, А.Н. Липовецкий.
Национальный научный центр “Институт кардиологии им. акад. Н.Д. Стражеско” АМН Украины, г. Киев;
Санаторий “Украина” (Ворзель) ЗАО “Укрпрофздравница”, г. Киев.
Укркардіо
Источник
