Инфаркт миокарда после ангиопластики

Заболевания сердечно-сосудистой системы нередко приводят к летальным последствиям. Своевременное адекватное лечение – условие сохранения жизни. Стентирование при инфаркте миокарда – процедура, которая способна остановить патологические процессы и предотвратить осложнения.
Общая информация об инфаркте
Сколько человек будет жить после инфаркта, зависит от того, насколько сильно повреждены ткани сердца, и какую площадь охватил процесс. Миокард – главная сердечная мышца, отвечающая за перекачку крови из желудочков в предсердия. При инфаркте происходит омертвение части этой мышцы. Это приводит к нарушениям в работе сердца вплоть до его остановки.
Инфаркт происходит из-за нехватки питания миокарда. Виной тому нередко служат холестериновые бляшки, которые перекрывают ток крови по коронарной артерии и другим сосудам. Дело в том, что обеспечение миокарда кислородом зависит от тонких сосудов, в которые разветвляется коронарная артерия. Недостаток питательных компонентов приводит к омертвению тканей или инфаркту.
Если жизнь удалось сохранить, на месте инфаркта образуется соединительная ткань. В итоге сердце не выполняет своих функций в полном объеме, а на органе образуется рубец, занимающий прежнее место мышц.
Что такое стентирование
Стентирование сосудов сердца – сложная процедура. Она особенно эффективна в первые часы после наступления инфаркта. Если случился инфаркт миокарда, провести стентирование должен опытный врач. Эта операция преграждает дальнейшее омертвение тканей и уменьшает осложнения.
Стент – тончайшая металлическая конструкция, своего рода пружина. Такое оборудование ставят в просвет коронарной артерии внутри сосуда. Расширяясь, оно обеспечивает нормальный просвет сосуда и способствует восстановлению полноценного кровообращения.
Чтобы установить стент, не требуется выполнять разрезы грудины. Его вводят через небольшое отверстие в бедренной артерии. Обычно операция не сопровождается кровопотерей или осложнениями. Длительность процедуры составляет от 15 минут до полутора часов.
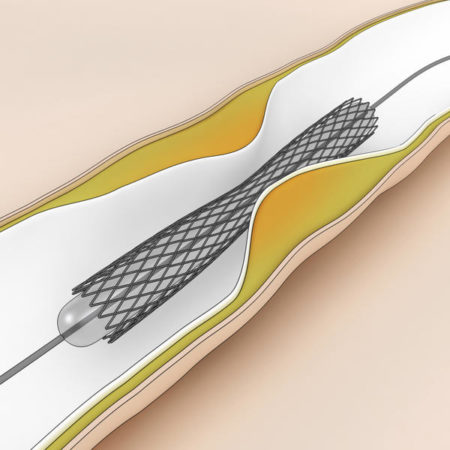
Когда оборудование установлено внутрь сосуда, состояние пациента постепенно стабилизируется. Буквально через 2-3 суток больного выписывают и наблюдают в рамках амбулаторного лечения.
После операции требуется принимать лекарства, назначенные врачом. Обычно это таблетки, разжижающие кровь. Их нужно пить столько, сколько рекомендовано.
Повод для стентирования сосудов
Чаще всего стент устанавливается при инфаркте для снижения рисков и постинфарктных осложнений. Но почему требуются такие крайние меры?
Заболевание проще предупредить, чем бороться с тяжелыми последствиями. Многие люди не знают, что недостаточное кровоснабжение миокарда приводит к ишемии. Ухудшение кровообращения происходит по разным причинам. Чаще всего нарушение в сосудах вызвано атеросклеротическими изменениями.
Холестериновые бляшки уменьшают просвет сосудов. Это изменение наблюдается в разных местах в организме. Однако сужение коронарной артерии наиболее опасно.
Когда возрастает нагрузка на органы и сосуды, например, при интенсивной ходьбе или физических упражнениях, организм нуждается в большем количестве кислорода. Это стимулирует сердце сокращаться быстрее. Из-за холестериновых отложений питание миокарда нарушается, и ускорение сокращений затрудняется. Возрастает риск инфаркта.
Важно! Если человек испытывает боли за грудиной или в области сердца, и они не проходят в течение 20 минут, состояние может закончиться инфарктом!
Проведение стентирования сосудов показано в таких случаях:
- неоднократные предынфарктные состояния,
- периодические приступы стенокардии,
- тяжелый инфаркт.
В вышеописанных случаях установка стента внутрь сосуда крайне желательна.
Применение ангиопластики
Некоторые считают, что установка стента должна проводиться уже при явных признаках ухудшения кровообращения. Однако есть процедура, которая, обеспечивая временный эффект, восстанавливает кровообращение в сосудах.
Увеличение просвета в артериях, заполненных холестериновыми бляшками, выполняется с помощью баллонной ангиопластики. Хирург вводит в полость закупоренного сосуда специальный баллон, который раздувается и вдавливает холестериновое отложение в стенку сосуда. В итоге восстанавливается кровообращение в артерии.
Недостаток этой процедуры в том, что результата хватает ненадолго. У большей половины прооперированных лиц наблюдалась повторная закупорка сосудов. Чаще всего нормальное кровообращение в коронарной артерии сохранялось не больше, чем на полгода.
Виды стендов
От правильно поставленного стента эффекта больше, чем от ангиопластики. Операция позволяет надолго сохранить нормальное кровообращение в сосудах.
Стенты различают по размерам и структуре. Они бывают:
- сеточные,
- кольцевые,
- проволочные,
- тубулярные.
Разработано более 400 видов стентов. Для их изготовления используются высококачественные металлы, которые не окисляются и не взаимодействуют с кровью. Стала возможной установка стента со специальным полимерным покрытием, которое в течение нескольких месяцев выделяет лекарственные вещества, препятствующие обрастанию конструкции гладкомышечной тканью внутри сосуда.

Внимание! Хотя стоимость стентов, покрытых лекарством, в несколько раз дороже обычных, пациенту с таким оборудованием требуется принимать меньше медицинских препаратов. Стенты с полимерным покрытием служат намного дольше, обеспечивая качественное кровообращение.
Ход операции
Стентирование сосудов сердца проводится опытным хирургом. В зависимости от сложности состояния пациента операция длится до трех часов. Общий наркоз не требуется, что позволяет проводить процедуру тем, кому такой тип анестезии противопоказан.
Подготовка к операции
Хотя операция проводится с помощью высокоточного современного оборудования, организм пациента следует правильно подготовить.
- Проводится анестезия.
- Вводятся препараты для разжижения крови.
После подготовительного этапа врач приступает к самой процедуре.
Установка стента
Место введения катетера обрабатывается антисептиком. В отверстие вводится небольшое оборудование. Все манипуляции внутри кровеносной системы отражаются на мониторе.
Катетер-проводник подводится к месту суженного сосуда. Высвобождается надувной баллон, который раздвигает стенки сосуда, возвращая их нормальный просвет.
Через то же отверстие вводится другой катетер с подготовленным стентом на конце. Он располагается в нужном месте, раздувается до требуемого диаметра и прижимается к стенкам сосуда.
Катетер удаляется. Место разреза фиксируется тугой повязкой для предотвращения кровопотери. В ближайшие часы после проведения операции пациент должен лежать в обездвиженном состоянии. Необходим медицинский контроль.
Самочувствие во время операции
Так как процедура проводится только под местным наркозом, во время операции человек постоянно находится в сознании. По просьбе врача пациент может выполнять различные дыхательные манипуляции.
Нет каких-либо болевых ощущений. Место введения катетера обезболивается. Перемещение оборудования внутри сосудистой системы не ощущается, так как стенки сосудов лишены нервных окончаний.
Нет никаких болей и во время расширения сосуда. Процедура практически никак не ощущается. Буквально через несколько дней человек может продолжить полноценную жизнь.
Подробнее процедура описана на видео:
Возможные осложнения
От поставленного стента осложнений практически не возникает. Люди быстро восстанавливаются, так как операция очень щадящая.

К наиболее вероятным осложнениям относятся:
- рестеноз,
- тромбоз.
Рестеноз – повторная закупорка сосуда. К счастью, после установления стентов такое состояние возникает крайне редко. Использование стентов с полимерным лекарственным покрытием значительно снижает риск данного осложнения.
Чтобы предотвратить образование тромбов в месте установки стента, необходимо строго по графику принимать все лекарства, назначенные хирургом. В частности, назначают аспирин.
Грамотная реабилитация
Многие, кому была проведена такая операция, говорят: «Мне поставили стент: как жить дальше?». На самом деле правильно проведенный этап реабилитации становится залогом долгой и счастливой жизни без потребности в проведении повторного стентирования.
Для полноценно восстановления необходимы такие мероприятия:
- лечебная физкультура,
- диета,
- правильный настрой.
Хорошее здоровье зависит от физической активности. Не стоит заниматься тяжелыми видами спорта и перегружать сердце. Это противопоказано. Нужно подобрать комплекс упражнений, которые будут эффективно поддерживать организм. Этот вопрос рекомендуется обсудить с врачом.

Тренироваться лучше каждый день. Если трудно, допускаются однодневные перерывы 1-2 раза в неделю. Каждое занятие длится примерно полчаса. Избавившись от избыточного веса и жировых отложений, станет легче поддерживать состояние сосудов.
Грамотно подобранный комплекс упражнений стабилизирует артериальное давление. Это снижает риск инсультов и инфаркта и увеличивает продолжительность жизни.
Холестерин необходим нашему организму каждый день. Однако чаще человек употребляет намного больше, чем нужно. Это приводит к росту показателя липопротеинов пониженной плотности. Если следить за уровнем вредного холестерина, проще предотвратить нарастание бляшек на сосудах.
Поддерживать уровень холестерина в норме поможет диета. Рацион должен содержать жиры. Однако лучше увеличить количество жиров растительного происхождения и уменьшить животного. Важно включить в меню такие продукты:
- бобовые,
- свежие овощи и фрукты,
- нежирная рыба.
После проведения стентирования запрещены алкогольные напитки, соления, жирная и жареная пища. Это поможет поддерживать здоровье в норме.
Хотя после проведения стентирования люди испытывают определенные переживания, лучше сосредоточиться на положительном, соблюдать все рекомендации врача и принимать назначенные препараты. От этого зависит жизнь, ведь поставить стент – только начало. Жизненно важно вести правильный образ жизни.
Важно! Чтобы сохранить жизнь после проведения серьезных вмешательств на сердце, важно и дальше внимательно следить за состоянием организма. Регулярно измерять артериальное давление, пульс, если нужно, корректировать эти показатели.
Своевременное проведение грамотного хирургического вмешательства поможет сохранить жизнь и здоровье человека, избежав инвалидности. Полный отказ от вредных привычек и здоровое питание – не сложный процесс, а стиль жизни, приносящий настоящее удовлетворение и отличное самочувствие каждый день!
Загрузка…
Источник
Содержание:
Инфаркт миокарда (ИМ) – самая серьезная клиническая форма ишемии сердца. Это острое, угрожающее жизни, состояние, обусловленное относительным либо абсолютным недостатком кровоснабжения определенной части миокарда вследствие тромбоза коронарной артерии, в результате чего формируется очаг некроза, т.е. область с отмершими клетками – кардиомиоцитами.
Инфаркт сердца – одна из ведущих причин смертности населения планеты. Его развитие напрямую зависит от возраста и пола человека. В связи с более поздним появлением атеросклероза у женщин инфаркты диагностируются у них в 3–5 раз реже, чем у мужчин. В группу риска попадают все представители мужского пола, начиная с 40-летнего возраста. У людей обоих полов, перешедших рубеж 55–65 лет, заболеваемость примерно одинакова. По статистике 30–35% всех случаев острого инфаркта сердечной мышцы заканчиваются летальным исходом. До 20% внезапных смертей вызваны этой патологией.
Причины инфаркта
Главные причины развития ИМ:
- Атеросклероз сосудов сердца, в частности коронарных артерий. В 97% случаев атеросклеротическое поражение стенок сосудов приводит к развитию ишемии миокарда с критическим сужением просвета артерий и длительным нарушением кровоснабжения миокарда.
- Тромбоз сосудов, к примеру, при коронарите различного генеза.Полное прекращение кровоснабжениямышцы происходит вследствиеобтурации (закупорки) артерий или мелких сосудов атеросклеротической бляшкой или тромбом.
- Эмболия венечных артерий, например, при септическом эндокардите, реже заканчивается образованием некротического очага, тем не менее являясь одной из причин формирования острой ишемии миокарда.
Нередко встречается сочетание вышеперечисленных факторов: тромб закупоривает спастически суженный просвет артерии, пораженной атеросклерозом или формируется в области атеросклеротической бляшки, выпяченной из-за произошедшего кровоизлияния в ее основание.
- Пороки сердца. Коронарные артерии могут отходит от аорты вследствие формирования органического поражения сердца.
- Хирургическая обтурация. Механическое вскрытие артерии или ее перевязка во время проведения ангиопластики.
Факторы риска инфаркта миокарда:
- Пол (у мужчин чаще).
- Возраст (после 40–65 лет).
- Стенокардия.
- Порок сердца.
- Ожирение.
- Сильный стресс или физическое перенапряжение при имеющейся ИБС и атеросклерозе.
- Сахарный диабет.
- Дислипопротеинемия, чаще гиперлипопротеинемия.
- Курение и прием алкоголя.
- Гиподинамия.
- Артериальная гипертония.
- Ревмокардит, эндокардит или другие воспалительные поражения сердца.
- Аномалии развития коронарных сосудов.
Механизм развития инфаркта миокарда
Течение болезни делится на 5 периодов:
- Прединфарктный (стенокардия).
- Острейший (острая ишемия сосудов сердца).
- Острый (некробиоз с формированием некротической области).
- Подострый (стадия организации).
- Постинфарктный (образование рубца в месте некроза).
Последовательность патогенетических изменений:
- Нарушение целостности атеросклеротического отложения.
- Тромбоз сосуда.
- Рефлекторный спазм поврежденного сосуда.
При атеросклерозе избыточный холестерин откладывается на стенках сосудов сердца, на которых образуются липидные бляшки. Они сужают просвет пораженного сосуда, замедляя кровоток по нему. Различные провоцирующие факторы, будь то гипертонический криз или эмоциональное перенапряжение, приводят к разрыву атеросклеротического отложения и повреждению сосудистой стенки. Нарушение целостности внутреннего слоя артерии активирует защитный механизм в виде свертывающей системы организма. К месту разрыва прилипают тромбоциты, из которых формируется тромб, закупоривающий просвет сосуда. Тромбоз сопровождается выработкой веществ, приводящих к спазмированию сосуда в области повреждения либо по всей его длине.
Клиническое значение имеет сужение артерии на 70% размера ее диаметра, при этом просвет спазмируется до такой степени, что кровоснабжение не может быть компенсировано. Это возникает вследствие атеросклеротических отложений на стенки сосудов и ангиоспазма. В результате нарушается гемодинамика области мышцы, получающей кровь через поврежденное сосудистое русло. При некробиозе страдают кардиомиоциты, недополучая кислород и питательные вещества. Нарушается метаболизм и функционирование сердечной мышцы, ее клетки начинают отмирать. Период некробиоза длится до 7 часов. При незамедлительно оказанной в этот промежуток времени медицинской помощи происходящие изменения в мышце могут быть обратимы.
При формировании некроза в пораженной области восстановить клетки и повернуть процесс вспять невозможно, повреждения приобретают необратимый характер. Страдает сократительная функция миокарда, т.к. некротизированная ткань не участвует в сокращении сердца. Чем обширнее область поражения, тем сильнее снижается сократимость миокарда.
Единичные кардиомиоциты или небольшие их группы гибнут спустя примерно 12 часов от начала острого заболевания. Через сутки микроскопически подтверждается массовое омертвление клеток сердца в зоне поражения. Замещение области некроза соединительной тканью начинается через 7–14 дней от начала инфаркта. Постинфарктный период продолжается 1,5–2 месяца, в течение которых окончательно формируется рубец.
Передняя стенка левого желудочка – наиболее частое место локализации некротической зоны, поэтому в большинстве случаев выявляется трансмуральный ИМ именно этой стенки. Реже поражается верхушечная область, задняя стенка или межжелудочковая перегородка. Инфаркты правого желудочка в кардиологической практике встречаются редко.
Классификация инфаркта миокарда
Относительно размера поражения ткани инфаркт миокарда бывает:
- Мелкоочаговый. Формируется один или несколько маленьких по размеру некротических участков. Диагностируется в 20% случаев от общего числа инфарктников. У 30% пациентов мелкоочаговый инфаркт трансформируется в крупноочаговый.
- Крупноочаговый (чаще трансмуральный). Образуется обширная область некроза.
По глубине некротического поражения различают:
- Трансмуральный. Некротическая область охватывает всю толщу миокарда.
- Субэпикардиальный. Участок с отмершими кардиомиоцитами прилегает к эпикарду.
- Субэндокардиальный. Некроз сердечной мышца в районе прилегания к эндокарду.
- Интрамуральный. Участок некроза находится в толще левого желудочка, но не доходит до эпикарда или эндокарда.
В зависимости от кратности возникновения:
- Первичный. Возникает первый раз.
- Повторный. Развивается через 2 месяца или позже после начала первичного.
- Рецидивирующий. Появляется на стадии формирования рубцовой ткани первичного инфаркта, т.е. в течение первых 2 мес. от первичного острого поражения миокарда.
Относительно локализации процесса:
- Левожелудочковый.
- Правожелудочковый.
- Септальный, или инфаркт межжелудочковой перегородки.
- Сочетанный, к примеру переднебоковой ИМ.
Отталкиваясь от электрокардиологических изменений, фиксируемых на кардиограмме:
- Q-инфаркт. Электрокардиограмма фиксирует сформировавшийся патологический з. Q или желудочковый комплекс QS. Изменения характерны для крупноочаговых ИМ.
- Не Q-инфаркт с инверсией з. Т и без патологии з. Q. Чаще встречается при мелкоочаговых инфарктах.
В зависимости от развития осложнений:
- Неосложненный.
- Осложненный.
Формы острого ИМ, относительно наличия и места расположения болей:
- Типичная. Боль сосредоточена в прекардиальной либо загрудинной области.
- Атипичная. Форма заболевания с атипичной локализацией болей:
Периоды заболевания:
- Острейший.
- Острый.
- Подострый.
- Постинфарктный.
Симптомы инфаркта миокарда
Интенсивность и характер болевых ощущений зависят от нескольких факторов: размера и локализации некротического очага, а также стадии и формы инфаркта. У каждого пациента клинические проявления различны в силу индивидуальных особенностей и состояния сосудистой системы.
Признаки типичной формы инфаркта миокарда
Яркая клиническая картина с типичным и выраженным болевым синдромом наблюдается при крупноочаговом (трансмуральном) инфаркте сердца. Течение болезни разделяю на определенные периоды:
- Прединфарктный, или продромальный период. У 43–45% инфарктников этот период отсутствует, т.к. болезнь начинается внезапно. Большинство пациентов перед инфарктом отмечают учащение приступов стенокардии, загрудинные боли становятся интенсивными и продолжительными. Изменяется общее состояние – снижается настроение, появляется разбитость и страх. Эффективность антиангинальных средств значительно снижается.
- Острейший период (от 30 мин до нескольких часов). При типичной форме острый инфаркт сопровождается нестерпимой загрудинной болью с иррадиацией в левую сторону туловища – руку, нижнюю челюсть, ключицу, предплечье, плечо, область между лопатками. Редко под лопатку или левое бедро. Боли могут быть жгучими, режущими, давящими. Некоторые ощущают распирание в груди или ломоту. В течение нескольких минут боль достигает своего максимума, после чего сохраняется до часа и дольше, то усиливаясь, то ослабевая.
- Острый период (до 2 суток, при рецидивирующем течении до 10 дней и дольше). У подавляющего большинства больных ангинозная боль проходит. Ее сохранение свидетельствует о присоединении эпистеноперикардиального перикардита либо о продолжительном течении ИМ. Нарушения проводимости и ритма сохраняются, также как и артериальная гипотензия.
- Подострый период (длительность – 1 мес). Общее состояние пациентов улучшается: температура нормализуется, проходит одышка. Полностью или частично восстанавливается сердечный ритм, проводимость, звучность тонов, но блокада сердца регрессу не поддается.
- Постинфарктный период – завершающий этап течения острого ИМ, длящийся до 6 месяцев. Некротическая ткань окончательно заменяется плотным рубцом. Сердечная недостаточность устраняется за счет компенсаторной гипертрофии сохранившегося миокарда, но при обширной площади поражения полная компенсация невозможна. В этом случае проявления сердечной недостаточности прогрессируют.
Начало боли сопровождается сильной слабостью, появлением обильного липкого (профузного) пота, чувством страха смерти, учащением сердцебиения. При физикальном обследовании выявляется бледность кожи, липкий пот, тахикардия и другие нарушения ритма (экстрасистолия, фибрилляция предсердий), возбуждение, одышка в покое. В первые минуты повышается артериальное давление, потом резко понижается, что свидетельствует о развивающейся недостаточности сердца и кардиогенном шоке.
При тяжелом течении развивается отек легких, иногда сердечная астма. Тоны сердца при аускультации приглушены. Появление ритма галопа говорит о левожелудочковой недостаточности, от степени выраженности которой зависит аускультативная картина легких. Жесткое дыхание, хрипы (влажные) подтверждают застой крови в легких.
Ангинозная боль в этом периоде нитратами не купируется.
В результате перифокального воспаления и некроза появляется лихорадка, сохраняющаяся на протяжении всего периода. Температура поднимается до 38,50 С, высота ее подъема зависит от размера некротического очага.
При мелкоочаговом инфаркте мышцы сердца симптоматика менее выражена, течение болезни не такое четкое. Редко развивается недостаточность сердца. Аритмия выражается в умеренной тахикардии, которая бывает не у всех больных.
Признаки атипичных форм инфаркта миокарда
Подобные формы характеризуются нетипичной локализацией болей, затрудняющей своевременную установку диагноза.
- Астматическая форма. Характерен кашель, приступы удушья, проливной холодный пот.
- Гастралгическая (абдоминальная) форма проявляется болями в эпигастральной области, рвотой, тошнотой.
- Отечная форма бывает при массивной очаге некроза, приводящем к тотальной сердечной недостаточности с отеками, одышкой.
- Церебральная форма характерна для пожилых пациентов с выраженным атеросклерозом не только сердечных, но и мозговых сосудов. Проявляется клиникой ишемии головного мозга с головокружениями, потерей сознания, шумом в ушах.
- Аритмическая форма. Единственным ее признаком может быть пароксизмальная тахикардия.
- Стертая форма отличается отсутствием жалоб.
- Периферическая форма. Боли могут быть только в руке, подвздошной ямке, нижней челюсти, под лопаткой. Иногда опоясывающая боль схожа с болями, возникающими при межреберной невралгии.
Осложнения и последствия инфаркта миокарда
- Тромбоз в желудочках.
- Острый эрозивный гастрит.
- Острый панкреатит либо колит.
- Парез кишечника.
- Желудочное кровотечение.
- Синдром Дресслера.
- Острая, а в дальнейшем хроническая прогрессирующая недостаточность сердца.
- Кардиогенный шок.
- Постинфарктный синдром.
- Эпистенокардиальный перикардит.
- Тромбоэмболии.
- Аневризма сердца.
- Отек легких.
- Разрыв сердца, приводящий к его тампонаде.
- Аритмии: пароксизмальная тахикардия, экстрасистолия, внутрижелудочковая блокада, фибрилляция желудочков и другие.
- Инфаркт легких.
- Пристеночный тромбоэндокардит.
- Психические и нервные расстройства.
Диагностика инфаркта миокарда
Анамнез болезни, электрокардиографические признаки (изменения на ЭКГ) и характерные сдвиги ферментативной активности в сыворотке крови являются основным критериями при диагностике острого ИМ.
Лабораторная диагностика
В первые 6 часов острого состояния в крови выявляется повышенный уровень белка – миоглобина, участвующего в транспортировке кислорода внутрь кардиомиоцитов. В течение 8–10 часов больше чем на 50% увеличивается креатинфосфокиназа, показатели активности которой нормализуются к концу 2 суток. Этот анализ повторяют каждые 8 часов. Если получают троекратный отрицательный результат, то инфаркт сердца не подтверждается.
На более позднем сроке необходим анализ на определение уровня лактатдегидрогеназы (ЛДГ). Активность этого фермента увеличивается спустя 1–2 суток от начала массового омертвления кардиомиоцитов, по прошествии 1–2 недель приходит в норму. Высокой специфичностью отличается повышение изоформ тропонина, увеличение уровня аминотрансфераз (АСТ, АЛТ). В общем анализе – повышение СОЭ, лейкоцитоз.
Инструментальная диагностика
ЭКГ фиксирует появление отрицательного з. Т либо его двухфазность в определенных отведениях (при мелкоочаговом ИМ), патологии комплекса QRS или з. Q (при крупноочаговом ИМ), а также различные нарушения проводимости, аритмии.
Электрокардиография помогает определить обширность и локализацию области омертвения, оценить сократительную способность сердечной мышцы, выявить осложнения. Рентгенологическое исследование малоинформативно. На поздних этапах проводят коронарографию, выявляющую место, степень сужения или непроходимости коронарной артерии.
Лечение инфаркта миокарда
При подозрении на инфаркт сердца срочно вызывают скорую помощь. До приезда медиков нужно помочь больному принять полусидячее положение с согнутыми в коленях ногами, ослабить галстук, расстегнуть одежду, чтобы она не стягивала грудь и шею. Открыть форточку или окно для доступа свежего воздуха. Под язык положить таблетку аспирина и нитроглицерина, которые предварительно измельчить или попросить больного их разжевать. Это необходимо для более быстрого всасывания действующего вещества и получения скорейшего эффекта. Если ангинозные боли не прошли от одной таблетки нитроглицерина, то его следует рассасывать через каждые 5 минут, но не больше 3 таблеток.
Больной с подозрением на инфаркт сердца подлежит незамедлительной госпитализации в кардиологическую реанимацию. Чем раньше реаниматологи начнут лечение, тем благоприятнее дальнейший прогноз: можно предупредить развитие ИМ, предотвратить появление осложнений, сократить площадь очага некроза.
Основные цели первоочередных лечебных мероприятий:
- снятие болевого синдрома;
- ограничение некротической зоны;
- предотвращение осложнений.
Купирование болевых ощущений – один из важнейших и неотложных этапов лечения ИМ. При неэффективности таблетированного нитроглицерина, его вводят в/в капельно либо наркотический анальгетик (например, морфин) + атропин в/в. В некоторых случаях проводят нейролептанальгезию – в/в нейролептик (дроперидол) + анальгетик (фентанил).
Тромболитическая и антикоагулянтная терапия направлена на сокращение зоны некроза. Впервые сутки от появления первых признаков инфаркта для рассасывания тромба и восстановления кровотока возможно проведение процедуры тромболизиса, но для предотвращения гибели кардиомиоцитов эффективнее ее делать в первые 1–3 часа. Назначают тромболитические препараты – фибринолитики (стрептокиназа, стрептаза), антиагреганты (тромбо-АСС), антикоагулянты (гепарин, варфарин).
Антиаритмическая терапия. Для устранения нарушений ритма, сердечной недостаточности, восстановления метаболизма в ткани сердца применяют антиаритмические препараты (бисопролол, лидокаин, верапамил, атенолол), анаболики (ретаболил), поляризующую смесь и т.д.
Для лечения острой недостаточности сердца используют сердечные гликозиды (коргликон, строфантин), диуретики (фуросемид).
Для устранения психомоторного возбуждения применяют нейролептики, транквилизаторы (седуксен), седативные средства.
Прогноз заболевания зависит от быстроты оказания первой квалифицированной помощи, своевременности проведения реанимационных мероприятий, размера и локализации очага поражения миокарда, наличия либо отсутствия осложнений, возраста пациента и имеющихся у него сопутствующих сердечно-сосудистых патологий.
Источник
