Инфаркт миокарда и депрессия
Сердечно-сосудистые заболевания являются ведущей причиной смерти населения РФ (вклад в общую смертность составляет 57 %). [1] Депрессивные и тревожные расстройства часто сопутствуют острому инфаркту миокарда, ухудшая его клиническое течение и прогноз, оказывая негативное влияние на показатели социального функционирования и качество жизни больного.
По данным статистики, симптомы депрессивного спектра выявляются у 10–65 % пациентов, госпитализированных с ОИМ, при этом до 22 % из них имеют выраженную депрессию («большую депрессию»). Известно, что депрессивные расстройства, сочетаясь с соматической патологией, могут значительно ухудшить состояние больного. Так, например, смертность больных в течение 6 месяцев после перенесенного инфаркта миокарда у больных с депрессией в 6 раз выше, чем у тех, у которых подобных расстройств не возникало. [2]
Ключевыеслова: депрессия, тревога, лечение, острый инфаркт миокарда.
В Российских национальных рекомендациях по кардиоваскулярной профилактике (2011 г.) и в рекомендациях Европейского общества кардиологов по кардиоваскулярной профилактике в клинической практике (2012 г.) депрессия, тревога и другие психосоциальные факторы рассматриваются в качестве независимых ФР развития сердечно-сосудистых заболеваний (ССЗ) атеросклеротического генеза, а их профилактика и коррекция — как неотъемлемая составная часть первичной и вторичной профилактики ССЗ. [2]
Критерии диагностики депрессивного расстройства предусматривают стойкое (не менее 2 недель) снижение настроения или утрату интереса и удовольствия от любых видов деятельности, изменение в повседневной жизни в виде снижения работоспособности и социальной дезадаптации, изменения в соматической сфере. [4]
Особенности депрессивных состояний у кардиологических пациентов:
– амбулаторный уровень расстройств;
– наличие коморбидных депрессивному аффекту расстройств: астении, тревоги, кардиофобий, дереализации, ипохондрии, апатии, астенического аутизма, сенестопатий и алгий и т. д., которые зачастую преобладают в клинической картине;
– анозогнозия своего состояния. Даже пребывая в глубоком депрессивном состоянии, соглашаясь с врачом о подавленности настроения, отсутствии удовольствия от прежних занятий, пациенты не считают, что нуждаются в посторонней помощи или в приеме медикаментов, т. к. не расценивают это как психическое расстройство. Они объясняют все сложившимися обстоятельствами: физическим недомоганием, обострением соматического заболевания, неблагополучной социальной обстановкой. [4]
При этом аффективные нарушения существенно влияют на прогноз заболевания и на смертность. В наши дни можно выделить две группы эффектов- поведенческие и патофизиологические, которые обуславливают связь эмоциональных нарушений и ОИМ. [1]
Поведенческие эффекты. Депрессия и связанные с ней идеомоторные и волевые нарушения становятся серьезной преградой для успешной реабилитации после ОИМ. Показано, что частичное выполнение рекомендаций врача повышает годовую смертность на 44 %, а полное пренебрежение — на 80 %.
При депрессии больные реже соблюдают рекомендации врача по здоровому образу жизни: не придерживаются диеты, не выполняют физические упражнения, не участвуют в постепенном расширении двигательного режима, залеживаются в постели, не отказываются от курения и не корректируют прием алкоголя. Они не регулярно принимают препараты и реже участвуют в мероприятиях по вторичной профилактике.
К патофизиологическим эффектам депрессии, способствующим развитию ОИМ, относят активацию симпато — адреналовой системы с хроническим повышением уровня норадреналина и кортизола, которые запускают каскад патологических реакций, в том числе гиперкоагуляцию, склонность к воспалению, дефицит омега-3 жирных кислот и фолиевой кислоты, склонность к инсулинорезистентности (атерогенная теория ОИМ). К патофизиологическим механизмам относятся и устойчивое повышение частоты сердечных сокращений, увеличение реактивности ЧСС в ответ на повышение нагрузок, склонность к наджелудочковым и желудочковым аритмиям (аритмогенная теория ОИМ). [1]
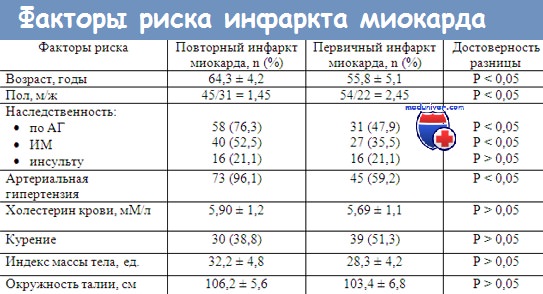
Установлена прямая зависимость выраженности аффективных расстройств и развития кардиоваскулярных осложнений: ИБС и ОИМ развиваются раньше и последствия их серьезнее при более тяжелых депрессивных состояниях. Уровень смертности у больных ИБС, перенесших ИМ и имеющих депрессию при выписке из стационара, по данным разных исследований в 1,5–6 раз выше, чем у пациентов не имеющих ДП. [5]
Для лечения тревожно — депрессивных состояний используются следующие подходы:
– Психотерапия
– Лекарственная терапия
– Комбинация психотерапии и психотропных средств.
Эффективность психотерапии напрямую зависит от сроков ее начала: чем раньше, тем лучше, т. к. помимо личностных особенностей на психологический статус влияют и внешние факторы, такие как реакция родственников на тяжелое заболевание, состояние других пациентов, работа медицинского персонала. Определенное значение в формировании патологических сдвигов у больных имеет неправильное поведение медицинского персонала — необоснованность ограничений, обсуждение при больном неясных вопросов диагностики и лечения, их озабоченные лица.
В этой ситуации адекватность получаемой информации играет решающую роль в правильном понимании ситуации, чтобы в дальнейшем больной стал активным союзником врача в борьбе за здоровье. На первом этапе предпочтительны индивидуальные психотерапевтические беседы с кардиологом (лечащим врачом) или психотерапевтом, хорошо осведомленным в вопросах кардиологии.
Сам факт срочной госпитализации, осознание того, что болезнь представляет угрозу жизни, опыт пребывания в палате интенсивной терапии, случаи резкого ухудшения состояния или смерти других больных усугубляют психический статус больного. В исследовании D. K. Mosreletal показано, что наличие тревоги в пределах 48 ч от момента ОИМ значительно увеличивает вероятность развития кардиоваскулярных осложнений (рецидивов ИМ, фибрилляции желудочков, устойчивой желудочковой тахикардии и смерти) на стационарном этапе наблюдения. Высокий уровень тревоги в течение первой недели после ОИМ ассоциируется с увеличением риска кардиоваскулярной смерти и необходимостью реваскуляризации в течение 31-ого мес наблюдения.
Поэтому в первые 2 -3 недели в случае развития тревожных состояний оправдано добавление в стандартную кардиотропную терапию препарата феназепам в суточной дозе 1 мг. При этом снижается уровень тревоги, улучшаются показатели сна. Отмечено статистически значимое уменьшение как наджелудочковых, так и желудочковых экстрасистол. [9] Добавление препарата феназепам в суточной дозе 1 мг целесообразно в течение 20 дней из-за быстрого развития синдрома зависимости к транквилизаторам бензодиазепинового ряда. [9] В дальнейшем для уменьшения симптомов тревоги перспективно применение небензодиазепиновых транквилизаторов, к которым привыкание не развивается, например, гидроксизина или отечественного препарата афобазола. [5]
При депрессивных и тревожно-депрессивных состояниях препаратами выбора являются антидепрессанты. Антидепрессанты нормализуют патологически измененное гипотимическое (депрессивное) настроение и способствуют редукции когнитивных, двигательных и соматовегетативных проявлений, обусловленных депрессией. В то же время антидепрессанты, помимо собственно антидепрессивного, имеют выраженное противотревожное действие, в связи с чем они эффективны в лечении смешанных тревожно-депрессивных состояний. Для использования в общемедицинской практике рекомендуются антидепрессанты новых поколений, предпочтительно селективные ингибиторы обратного захвата серотонина (СИОЗС). У препаратов этой группы благоприятный кардиальный профиль, они хорошо переносятся и безопасны даже у наиболее уязвимых категорий больных, например, пожилых больных и больных ССЗ. Наибольшая доказательная база по применению антидепрессантов в кардиологической практике накоплена в отношении 2 препаратов из группы СИОЗС — сертралина и циталопрама. Данные рандомизированных клинических исследований свидетельствуют, что сертралин и циталопрам безопасны при назначении больным ИБС и при этом эффективны при лечении депрессий средней тяжести, тяжелых и рекуррентных депрессий. Эти препараты являются препаратами выбора для лечения депрессий после перенесенных ИМ, других кардиоваскулярных событий. Трициклические антидепрессанты и ингибиторы моноаминоксидазы больным ССЗ не рекомендуются, ввиду их кардиотоксических эффектов. Показано, что лечение постинфарктной депрессии не только способствует улучшению психоэмоционального состояния больных, но и позитивно влияет на приверженность пациентов к лечению в целом. [5]
На этапе реабилитации проводятся основные психотерапевтические мероприятия, включающие групповые дискуссии, обучение приемам релаксации, индивидуальные психотерапевтические занятия.
На групповых занятиях обсуждаются важные вопросы вторичной профилактики. Информация — это необходимое, но недостаточное условие для активного вовлечения больных в программы реабилитации. Требуются специальные усилия по созданию соответствующей мотивации. Важное значение в этом плане имеет эмоциональная привлекательность занятий. Необходимо, чтобы вся информация, передаваемая больному, воспринималась им как нужная и к тому же эмоционально привлекательная. Сведения должны быть насыщены примерами, близкими и понятными больному.
Однако самым важным, ключевым моментом методики, призванным решающим образом повлиять на создание мотивации к активному участию в реабилитации, является групповая дискуссия. Обсуждение проблем, актуальных для всех членов группы, приводит к более адекватному и глубокому пониманию путей их решения, способствует выработке правильных установок и активной позиции, что в конечном счете и создает столь необходимую мотивацию. [6,7]
Проводятся также занятия по аутогенной тренировке, суть которых сводится к овладению пациентами методов самовнушения на фоне психического и мышечного расслабления. Эти занятия позволяют повышать способности человека к саморегуляции психического настроя, состояния и тем самым помогают ему преодолевать трудности, возникшие вследствие болезни.
Индивидуально с врачом психотерапевтом проводятся когнитивно-поведенческие занятия, в ходе которых выявляются и модифицируются дисфункциональные когниции, вызывающие неадекватные или болезненные эмоции. С помощью специальных техник прорабатываются и закрепляются адаптативные реакции, что приводит к снижению симптомов тревоги и депрессии.
По данным исследований когнитивно-поведенческая терапия приводила к снижению частоты сердечных сокращений (ЧСС) и достоверному улучшению показателей ВРС у пациентов с ИБС и тяжелой депрессией. Эти исследования позволяют предполагать положительное влияние проводимой терапии на патофизиологические механизмы, общие для депрессии и ИБС. [8]
Литература:
- Черняева М. С., Петрова М. М., Савченко А.А, Шимохина Н. Ю., Каскаева Д. С., Пронина Е. А., Острый инфаркт миокарда и расстройства аффективного спектра. // Сибирское медицинское обозрение, 2015,№ 3. С. 6–9.
- Глушков Р. Г., Андреева Н. И., Алеева Г. Н. Депрессии в общемедицинской практике //РМЖ. 2005. Т. 13. № 12. С. 858–60.)
- Крюков Н. Н., Николаевский Е. Н., Поляков В. П., Ишемическая болезнь сердца. Самара, 2010, глава 8.
- Артюхова М. Г., Депрессия и тревога у кардиологических больных //РМЖ.2008. № 12. С. 1724
- Национальные рекомендации по кардиоваскулярной профилактике. 2011.
- Николаева Л. Ф., Зайцев В. П. Школа для больных инфарктом миокарда// М., 1988. С.5–15.
- Николаева Л. Ф., Аронов Д. М. Реабилитация больных ишемической болезнью сердца. М., Медицина. 1988. 288 с.
- Васюк Ю. А., Лебедев А. В., Депрессия, тревога и инфаркт миокарда: все только начинается, часть 2 // Рациональная фармакотерапия в кардиологии, № 4, Т 3,2007
- Поликарпов Л. С., Деревянных Е. В., Яскевич Р. А. Влияние препарата феназепама на уровень тревоги и депрессии, показатели сна, нарушение ритма сердца у больных острым инфарктом миокарда // Сибирский медицинский журнал,2012,Т 2,№ 27
Основные термины (генерируются автоматически): больной, депрессия, вторичная профилактика, антидепрессант, занятие, лечение, лечение депрессий, медицинский персонал, острый инфаркт миокарда, суточная доза.
Источник
Социальные факторы инфаркта миокарда. Стресс и депрессия как причина инфаркта миокардаВместо психологического типа поведения А (энергичные, амбициозные, “сгорающие” на работе люди) теперь всё больше говорят о депрессии. Разумеется, психиатрам, психологам и кардиологам предстоит ещё немало потрудиться, чтобы определить значение различных вариантов эмоциональных расстройств в развитии ИБС, инфаркта миокарда, осложнений постинфарктного периода. Коснёмся роли психосоциального стресса как фактора риска сердечно-сосудистой патологии. Теоретическая основа для этого была заложена около тысячи лет назад великим Ибн Синой. Свои взгляды о решающей роли покоя и душевного равновесия в сохранении здоровья и выздоровлении он подкрепил классическим экспериментом с двумя баранами, которых держал на одинаковой диете. Второй баран, у которого не было подобного соседства, продолжал здравствовать ещё долгое время…
Заметим, что данное исследование проводилось в благополучной Западной Германии ещё до объединения страны. Вот так сжато и метко описали патогенез инфаркта миокарда В. П. Образцов и Н. Д. Стражеско. Со временем это фундаментальное открытие обросло подробностями, но не изменилось по сути: в основе развития инфаркта миокарда лежит тромбоз венечной артерии. Факторы риска ИБС и патогенетические основы развития инфаркта миокарда были достаточно подробно рассмотрены в пособии “Диагностика и лечение дислипидемий” (В. А. Крыжановский, 1995). Вкратце напомним основные положения. Как отмечают Е. Falk, P. К. Shah, V. Fuster (1995), конкретные пусковые механизмы развития инфаркта миокарда требуют дальнейшего изучения. – Также рекомендуем “Патогенез инфаркта миокарда. Механизмы развития инфаркта миокарда” Оглавление темы “Причины и диагностика инфаркта миокарда”: |
Источник
В настоящее время депрессию в легкой и средней степени тяжести успешно могут лечить кардиологи или врачи общей практики. Назначение неселективных трициклических антидепрессантов (амитриптилин, тизерцин) постинфарктным больным нежелательно вследствие их негативного влияния на сердечно-сосудистую систему. Их прием может сопровождаться соматотропными и поведенческими реакциями (сонливость, снижение уровня внимания, ухудшение памяти, нарушение мотивации движения), а также рефракторной тахикардией, ортостатической гипотонией (особенно у пожилых больных), удлинением интервалов P-Q, QRS и Q-T ЭКГ.
Антидепрессанты нового поколения обладают селективностью, и в связи с этим они лишены вышеперечисленных побочных эффектов, характерных дня трициклических антидепрессантов. В то же время по антидепрессивной эффективности они им не уступают, а по переносимости и безопасности превосходят. Что очень важно, препараты новой группы антидепрессантов оказывают не только антидепрессивное действие, но и устраняют чувство тревоги, в связи с чем они эффективны у больных сопутствующей тревожной симптоматики, панических атак, фобических синдромов.
При лечении депрессий у больных, перенесших инфаркт, следует придерживаться следующих основных принципов:
1) отдавать предпочтение антидепрессантам нового поколения с благоприятным кардиальным профилем;
2) не превышать рекомендуемые суточные дозы антидепрессантов: циталопрам (ципрамил) — 10-20 мг/сут (обычная доза 20 мг/сут), миансерин (леривон) — 30-60 мг/сут, сертралин (золофт) — 25-200 мг/сут (обычная доза 100 мг/сут в 2 приема), ксанакс — 0,75 мг/сут в 3 приема, флуоксетин — 10-20 мг/сут однократно утром (обычная доза 20 мг/ сут), флувоксамин (феварин) — 25—100 мг/сут (обычная доза 100 мг/сут), пароксетин (паксил) — 10-60 мг/сут (обычная доза 20 мг/сут), тианептин (коаксил) — 75 мг/сут в 3 приема (обычная доза 37,5 мг/сут), у больных старше 70 лет 50 мг/сут в 2 приема. Эти дозы являются терапевтическими при депрессиях легкой и средней тяжести и в большинстве случаев титрования дозы не требуется.
Из перечисленных выше препаратов обладают преимущественно седативным действием следующие антидепрессанты: пароксетин, флувоксамин, миансерин и миртазапин; обладают активирующи действием: моклобемид, флуоксетин, циталопрамин сертралин; нейтральным действием: тианептип, пиразидол и милнаципран;
3) учитывать некоторую отсроченность клипп ческого эффекта большинства антидепрессантон Антидепрессивный эффект нарастает постепенно и становится значимым к концу первых 2 нед. терапии. Желательно проинформировать об этом больного с тем, чтобы он не ожидал немедленного положительного действия после приема препарата. При недостаточной эффективности указанные выше дозы могут быть увеличены;
4) соблюдать определенную длительность куренвого приема — не менее 1,5 мес. При выраженых депрессивных расстройствах длительность лечения может быть увеличена до 4-6 мес и более в зависимости от состояния пациента. Для антидепрессии тов нового поколения привыкание, а также спид ром отмены нехарактерны. Эта особенность действия позволяет отменять их одномоментно, без предварительного снижения дозы, даже после дли тельного курса лечения.
Нестеров Ю.И.
Опубликовал Константин Моканов
Источник
