Инфаркт миокарда функция почек
Механизмы ухудшения функции почек при инфаркте миокарда
ОПП может развиваться при ИМ по нескольким причинам, включая уменьшение объема циркулирующей крови (ОЦК), снижение перфузии почек из-за нарушений сократимости миокарда левого желудочка и артериальную гипотензию, нередко провоцируемую или усугубляемую применением ингибиторов АПФ, блокаторов рецепторов ангиотензина II и диуретиков.
Кроме того, ОПП при ИМ могут индуировать рентген-контрастные агенты. Острое ухудшение функции почек при ОИМ может также быть связанным с эмболией внутрипочечных артерий и артериол кристаллами холестерина, источником которых являются атеросклеротические бляшки в аорте, стабильность фиброзной покрышки которых нарушается при неаккуратном проведении ангиографического катетера, реже – при применении тромболитиков и антикоагулянтов в неадекватных дозах [32–34].
В первой половине XX в. работами B. Folkow и A. Nill, а также R. Rachmer было установлено что кровоток через почку прямо пропорционален среднему артериальному давлению (АД), точнее – разности между величиной среднего АД (АДсред.) и венозного давления в почке (АДсред. – Рвеноз.) = ΔР, и обратно пропорционален общему сосудистому сопротивлению почки.
Кровоток = (АДсред. – АДвеноз. / (W R l) (1, 2, 3).
Сегодня считается неоспоримым, что почечный кровоток определяется в основном средним АД и степенью сокращения гладкомышечных клеток афферентной и эфферентной артериол [35]. Анализ уравнения, приведенного выше, позволяет предположить, что если градиент давления уменьшится на 50 %, то суммарный почечный кровоток должен снизиться также на 50 %.
Однако этого в реальных условиях не происходит, т. к. кровоток в почке регламентируется феноменом саморегуляции (в настоящее время ответственными за ауторегуляцию считаются два почечных механизма – миогенный механизм и клубочко-канальцевая обратная связь). Этот феномен гарантирует относительно постоянный почечный кровоток в ответ на изменение среднего почечного АД в диапазоне от 85 до 180–200 мм рт. ст.
Основываясь на описанном уравнении, данный феномен может иметь только одно объяснение – сопротивление кровотока в почке снижается пропорционально снижению системного АД. Гладкая мускулатура афферентных артериол расслабляется, увеличивается радиус артериол, в связи с этим снижается сопротивление кровотоку, что приводит к его увеличению.
Таким образом, снижение перфузионного давления стимулирует увеличение диаметра афферентных артериол, тем самым снижая градиент давления между артериями и гломерулярными капиллярами. Параллельно происходит увеличение тонуса эфферентных артериол, что также поддерживает почечный кровоток и перфузию на относительно неизменном уровне.
Следует также иметь в виду, что механизмы ауторегуляции CКФ практически не работают, если величина среднего составляет АД ≤ 70 мм рт. ст. (т. е. при АД менее 90/60 мм рт. ст.); кроме того, почечный кровоток и СКФ даже при АД, не выходящем за пределы диапазона ауторегуляции, могут существенно варьироваться под влиянием симпатической нервной системы и ренин-ангиотензин-альдостероновой системы (РААС).
У пациентов, не находящихся в условиях психоэмоционального и/или физического стресса и имеющих нормальное АД, роль симпатической иннервации в регуляции почечного кровотока невелика [35]. Однако давно известно, что при ОИМ происходят активация симпатической нервной системы и выброс катехоламинов, приводящие к констрикции сосудов почек и снижению почечного плазмотока [36, 37].
Афферентные и эфферентные гломерулярные артерии содержат как α-, так и β-адренорецепторы. Тем не менее число α-адренорецепторов значительно больше, в связи с чем некоторые катехоламины, в частности адреналин, может вызывать констрикцию как афферентных, так и эфферентных артериол [38]. Следствием спазма артериол почечного клубочка является увеличение почечного сосудистого сопротивления со снижением почечного кровотока.
Повышение активности симпатической нервной системы всегда приводит к снижению натрийуреза и экскреции осмотически связанной воды. Известно, что артериальная гипотензия и снижение сердечного выброса при ИМ ассоциировано с повышением давления в левом предсердии [39]. Повышение давления в левом предсердии неизбежно сопровождается увеличением продукции предсердного натрийуретического пептида, который в свою очередь увеличивает экскрецию натрия, почечный кровоток и СКФ.
Тем не менее при сердечной недостаточности и ИМ эффекты предсердного натрийуретического пептида постепенно ослабевают, в клетка-мишенях к нему постепенно формируется резистентность [40, 41]. Кроме того, при ишемии почечной ткани заметно увеличивается продукция перекисей и свободных радикалов кислорода, усиливающих вазоконстрикцию и оказывающих угнетающее действие на натрийурез [42].
Угнетают мочевую экскрецию натрия также и компоненты РААС (инициальная ее составляющая – ренин – всегда активируется в условиях почечной ишемии), усугубояющие нарушения внутрипочечной гемодинамики, а также индуцирующие процессы фиброгенеза и пролиферации мезангиальных клеток, особенно выраженные при усиливающейся депрессии почечной системы вазодилатации.
Дилатационная
кардиомиопатия – это первичное поражение
миокарда, характеризующееся выраженной
дилатацией полостей сердца и нарушением
систолической функции желудочков.
не
известна, но предполагают многие факторы:
а) следствие длительных нарушений
метаболизма в миокарде (дефицит фермента
лактатдегидрогеназы, дефицит карнитина,
недостаток в пище таурина, дефицит
селена и т.д.); б) наследственное заболевание
(описаны семейные формы заболевания, у
11 – 12% больных подтверждена генетическая
связь); в) следствие воспалительных
повреждений миокарда (энтеровирусная
инфекция, вирусы герпеса, Коксаки В,
гепатита С, цитомегаловирус).
В
результате воздействия этиологических
факторов нa сердце развивается повреждение
кардиомиоцитов с уменьшением количества
функционирующих миофибрилл. Это ведет
к прогрессированию сердечной
недостаточности, выражающейся в
значительном снижении сократительной
способности миокарда с быстрым развитием
дилатации полостей сердца.
жалобы:
одышка в покое и при физической нагрузке,
сердцебиения, перебои в работе сердца,
иногда приступы удушья, отеки нижних
конечностей, могут беспокоить боли в
области сердца. Объективно: верхушечный
толчок широкий, разлитой, смещен влево.
Границы сердца расширены в обе стороны.
Глухой I
тон, появляется патологический III
тон, ритм галопа.
У верхушки сердца
систолический шум (митральная
регургитация). В легких – в зависимости
от выраженности сердечной недостаточности
— от ослабления дыхания до влажных мелко-
и среднепузырчатых хрипов. Регулярность
пульса нарушают различные аритмии,
артериальное давление может несколько
понижаться.
—
кардиомегалии
—
нарушения ритма сердца
—
сердечной недостаточности
Дифференциальная
диагностика с пороками сердца,
миокардитами, миокардиодистрофиями,
перикардитами.
специфические
изменения лабораторных показателей не
характерны.
ЭКГ:
признаки гипертрофии ЛЖ, признаки
нарушения проводимости (блокада левой
ножки, АВ блокады) и сердечного ритма
(экстрасистолия, фибрилляция предсердий,
желудочковые тахикардии).
ЭХО-КГ:
расширение полостей сердца, снижение
фракции выбросадиффузная гипокинезия
стенок миокарда, относительная
трикуспидальная и митральная
недостаточность.
R
– графия органов грудной клетки:
увеличение кардиоторакального соотношения
более 0,5. Признаки венозного застоя в
малом круге кровообращения.
Также
для дифференциальной диагностики с
миокардитом применяется сканирование
миокарда меченым галлием, индием – III,
эндомиокардиальная бипсия.
направлено
на коррекцию ХСН. Применяют следующие
группы препаратов: ингибиторы
ангиотензинпревращающего фермента
(эналаприл, периндоприл), b-
адреноблокаторы (метопролола сукцинат,
бисопролол, карведилол), диуретики
(спиронолактон, торасемид), сердечные
гликозиды при постоянной форме
мерцательной аритмии, антиагреганты
(ацетилсалициловая кислота) или
антикоагулянты (варфарин) при мерцательной
аритмии.
Трансплантация
сердца.
Хроническая сердечная недостаточность: диагностика и лечение.
Диагностика поражения почек при ОКС/ОИМ осуществляется с использованием классификации RIFLE (Risk, Injury, Failure, Loss, End-Stage kidney disease), применяемой для классификации ОПП. Классификация определяет ОПП как острое (1–7 дней) и продолжительное (
Источник
- Архив журнала
/ - 2010
/ - №3
Острый инфаркт миокарда и почечная функция
Г.П. Арутюнов, Л.Г. Оганезова
Кафедра терапии Московского факультета РГМУ, Москва
Обсуждаются частота и прогностическое значение ухудшения почечной функции при остром инфаркте миокарда. Представлены подходы к диагностике почечной недостаточности при остром инфаркте миокарда и лечению этой категории пациентов.
Литература
1. Culleton B.F., Larson M.G., Evans J.C. et al. Prevalence and correlates of elevated serum creatinine levels: the Framingham Heart Study. Arch. Intern. Med. 1999; 159: 1785–1790.
2. Culleton B.F., Larson M.G., Wilson P.W. et al. Cardiovascular disease and mortality in a community-based cohort with mild renal insufficiency. Kidney Int. 1999;56:2214–2219.
3. Ronco C., House A.A., Haapio M. Cardiorenal syndrome: refining the definition of a complex symbiosis gone wrong. Intensive Care Med. 2008; 34: 957–962.
4. Meisinger C., Doring A., Lowel H.; KORA Study Group. Chronic kidney disease and risk of incident myocardial infarction and all-cause and cardiovascular disease mortality in middle-aged men and women from the general population. Eur. Heart J. 2006; 27(10): 1245–1250.
5. Wright R.S., Reeder G.S., Herzog C.A. et al. Acute myocardial infarction and renal dysfunction: a high-risk combination. Ann Intern Med. 2002; 137(7): 563–570.
6. Gibson C.M., Dumaine R.L., Gelfand E.V. et al.; TIMI Study Group. Association of glomerular filtration rate on presentation with subsequent mortality in non-ST-segment elevation acute coronary syndrome; observations in 13,307 patients in five TIMI trials. Eur. Heart J. 2004; 25(22): 1998–2005.
7. Masoudi F.A., Plomondon M.E., Magid D.J. Renal insufficiency and mortality from acute coronary syndromes. Am. Heart J. 2004; 147(4): 623–629.
8. InTIME-II Investigators. Intravenous NPA for the treatment of infracting myocardium early: InTIME II, a double-blind comparison of single-bolus lanoteplase vs accelerated alteplase for the treatment of patients with acute myocardial infarction. Eur. Heart J. 2000; 21(24): 2005–2013.
9. Tessone A., Gottlieb S., Barbash I.M. et al. Underuse of standard care and outcome of patients with acute myocardial infarction and chronic renal insufficiency. Cardiology. 2007; 108(3): 193–199.
10. Han J.H., Chandra A., Mulgund J. et al. Chronic kidney disease in patients with non-ST-segment elevation acute coronary syndromes. Am. J. Med. 2006; 119(3): 248–254.
11. Santopinto J.J., Fox K.A., Goldberg R.J. et al.; GRACE Investigators. Creatinine clearance and adverse hospital outcomes in patients with acute coronary syndromes: findings from the global registry of acute coronary events (GRACE). Heart. 2003; 89(9): 1003–1008.
12. Elsayed E.F., Tighiouart H., Griffith J. et al. Cardiovascular Disease and Subsequent Kidney Disease. Arch. Intern. Med. 2007; 167: 1130–1136.
13. Mehran R., Nikolsky E., Lansky A.J. et al. Impact of chronic kidney disease on early (30-day) and late (1-year) outcomes of patients with acute coronary syndromes treated with alternative antithrombotic treatment strategies: an ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) substudy. J.A.C.C Cardiovasc Interv. 2009; 2(8): 748–757.
14. Medalion B., Cohen H., Assali A. et al. The effect of cardiac angiography timing, contrast media dose, and preoperative renal function on acute renal failure after coronary artery bypass grafting. J. Thorac. Cardiovasc. Surg. 2010; 139(6): 1539–1544.
15. Lindeman R.D., Tobin J.D., Shock N.W. Association between blood pressure and the rate of decline in renal function with age. Kidney Int 1984; 26: 861–868.
16. Manttari M., Tiula E., Alikoski T. et al. Effects of hypertension and dyslipidemia on the decline in renal function. Hypertension 1995; 26: 670–675.
17. Fliser D., Franek E., Joest M. et al. Renal function in the elderly: impact of hypertension and cardiac function. Kidney Int 1997; 51: 1196–1204.
18. Krop J.S., Coresh J., Chambless L.E. et al. A community-based study of explanatory factors for the excess risk for early renal function decline in blacks vs whites with diabetes: the Atherosclerosis Risk in Communities study. Arch. Intern. Med. 1999; 159: 1777–1783.
19. Efendigil M.C., Harley A., Deegan T. et al. Changes in glomerular filtration rate following myocardial infarction. Cardiovasc. Res. 1975; 9(6): 741–744.
20. Shusterman N., Strom B.L., Murray T.G. et al. Risk factors and outcome of hospital-acquired acute renal failure: clinical epidemiologic study. Am. J. Med. 1987; 83(1):65–71.
21. Liano F., Pascual J.; Madrid Acute Renal Failure Study Group. Epidemiology of acute renal failure: a prospective, multicenter, community-based study. Kidney Int. 1996; 50(3): 811–818.
22. Waikar S.S., Curhan G.C., Wald R. et al. Declining mortality in patients with acute renal failure, 1988 to 2002. J. Am. Soc. Nephrol. 2006; 17(4): 1143–1150.
23. Chronopoulos A., Cruz D.N., Ronco C. Hospital-acquired acute kidney injury in the elderly. Nat. Rev. Nephrol. 2010; 6(3): 141–149.
24. Kuitunen A., Vento A., Suojaranta-Ylinen R. et al. Acute renal failure after cardiac surgery: evaluation of the RIFLE classification. Ann Thorac Surg. 2006; 81(2): 542–546.
25. Hockman J.S., Sleeper L.A., Webb J.G. et al.; for the SHOCK investigators: Early revascularization in acute myocardial infarction complicated by cardiogenic shock. N. Engl. J. Med. 1999; 341:625–634.
26. Koreny M., Delle Karth G., Geppert A. et al Prognosis of patients who develop acute renal failure during the first 24 hours of cardiogenic shock after myocardial infarction. Am. J. Med. 2002; 112: 115–119.
27. Parikh С.R., Coca S.G. Long-term prognosis of acute kidney injury after acute myocardial infarction. Arch. Intern. Med. 2008; 168(9): 987–995.
28. Hasdai D., Holmes D.R., Califf R.M. et al. Cardiogenic shock complicating acute myocardial infarction: Predictors of death. Am. Heart. J. 1999; 138: 21–31.
29. Thakar C.V., Worley S., Arrigain S. et al. Influence of renal dysfunction on mortality after cardiac surgery: modifying effect of preoperative renal function. Kidney Int. 2005; 67(3): 1112–1119.
30. Forman D.E., Butler J., Wang Y, et al. Incidence, predictors at admission, and impact of worsening renal function among patients hospitalized with heart failure. J Am Coll Cardiol. 2004; 43(1): 61–67.
31. Lassnigg A/, Schmidlin D/, Mouhieddine M/, et al. Minimal changes of serum creatinine predict prognosis in patients after cardiothoracic surgery: a prospective cohort study. J. Am. Soc. Nephrol. 2004; 15(6): 1597–1605.
32. Мухин Н.А. Снижение скорости клубочковой фильтрации – общепопуляционный маркер неблагоприятного прогноза. Тер. архив. 2007; 6: 5–10.
33. Abuelo G.J. Normotensive ischemic acute renal failure. N. Engl. J. Med. 2007; 357: 797–805.
34. Modi K.S., Rao V.K. Atheroembolic renal disease. J. Am. Soc. Nephrol. 2001; 12: 1781–1787.
35. Moss N.G., Colinders R.E., Gottschalk C.W. Neural control of renal function. In Windhager E.E. (ed.) Renal physiology NY, Oxford University Press 1992.
36. Videbaek J., Christensen N.J., Sterndorff B. Serial determination of plasma catecholamines in myocardial infarction. Circulation. 1972; 46(5): 846–855.
37. McKenna O.C., Angelakos E.T. Adrenergic innervation of the canine kidney. Circ. Res. 1968; 22(3): 345–354.
38. Makita Y. Effects of adrenoceptor agonists and antagonists on smooth muscle cells and neuromuscular transmission in the guinea-pig renal artery and vein. Br. J. Pharmacol. 1983; 80(4): 671–679.
39. Cohn J.N., Khatri I.M., Hamosh P. Bedside catheterization of the left ventricle. Am. J. Cardiol. 1970; 25(1): 66–69.
40. Pichet R., Cantin M., Thibault G. et al. Hemodynamic and renal responses in physiological levels of ANF in conscious dog. J. Hypertens. 1989; 14: 104–110.
41. Gaillard C.A., Mizelle H.L., Mantani J.P. et al. ANF and blood pressure control: role of sodium and aldosterone. Am J Physiol 1990; 259: R973–R980.
42. Bongartz L.G., Cramer M.J., Doevendans P.A. et al. The severe cardiorenal syndrome: ‘Guyton revisited’ Eur. Heart J. 2005; 26(1): 11–17.
43. Liu P.P. Cardiorenal syndrome in heart failure: a cardiologist© s perspective. Can. J. Cardiol. 2008; 24(Suppl. B): 25B–29B.
44. Bellomo R., Kellum J.A., Mehta R. et al. Acute Dialysis Quality Initiative II: the Vicenza conference. Curr. Opin. Crit. Care. 2002; 8(6): 505–508.
45. Goldberg A., Hammerman H., Petcherski S. et al. Inhospital and 1-year mortality of patients who develop worsening renal function following acute ST-elevation myocardial infarction. Am. Heart J. 2005; 150: 330–337.
46. Li W.X., Chen H.D., Wnag X.W. et al. Predictive value of RIFLE classification on prognosis of critically ill patients with acute kidney injury treated with continuous renal replacement therapy. Chin. Med. J. (Engl.). 2009; 122(9): 1020–1025.
47. Ricci Z., Cruz D., Ronco C. The RIFLE criteria and mortality in acute kidney injury: A systematic review. Kidney Int. 2008; 73(5): 538–546.
48. Deinum J., Derkx F.H. Cystatin for estimation of glomerular filtration rate? Lancet 2000; 356: 1624–1625.
49. Thomas L., Huber A.R. Renal function – estimation of glomerular filtration rate. Clin. Chem. Lab. Med. 2006; 44(11): 1295–1302.
50. Dharnidharka V.R., Kwon C., Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis. Am. J. Kidney Dis. 2002; 40: 221–226.
51. Parikh C.R., Mishra J., Thiessen-Philbrook H. et al. Urinary IL-18 is an early predictive biomarker of acute kidney injury after cardiac surgery. Kidney Int. 2006; 70(1): 199–203.
52. Mishra J., Dent C., Tarabishi R. et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury following cardiac surgery. Lancet. 2005; 365: 1231–1238.
53. Windt W.A., Eijkelkamp W.B., Henning R.H. et al. Renal damage after myocardial infarction is prevented by renin-angiotensin-aldosterone-system intervention. J. Am. Soc. Nephrol. 2006; 17(11): 3059–3066.
54. Dragu R, Hammerman H. ST elevation myocardial infarction and renal impairment. Does it matter how we reperfuse? Acute Card Care 2007; 9(1):22–24.
55. The ESC Task Force. Expert consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease. The Task Force on ACE-inhibitors of the European Society of Cardiology. Eur. Heart J. 2004; 25: 1454–1470.
56. Hillege H.L., van Gilsta W.H., van Veldhuisen D.J. et al. Accelerated decline and prognostic impact of renal function after myocardial infarction and the benefits of ACE inhibition: the CATS randomized trial. Eur. Heart J. 2003; 24: 412–420.
57. Van Praet J.T., De Vriese A.S. Prevention of contrast-induced nephropathy: a critical review. Curr. Opin. Nephrol. Hypertens. 2007; 16(4): 336–347.
58. Krug H., Raszeja-Wanic B., Wochowiak A. et al. Intravascular coagulation in acute renal failure after myocardial infarction. Ann. Int. Med. 1974; 81: 494–497.
59. Yusuf S., Mehta S.R., Chrolavicius S. et al. Fifth Organisation to Assess Strategies in Acute Ischaemic Syndromes Investigators. Comparison of fondaparinux and enoxaparin in acute coronary syndrome. N. Engl. J. Med. 2006; 354(14): 1464–1476.
60. Medi C., Montalescot G., Budaj A. et al. et al. Reperfusion in patients with renal dysfunction after presentation with ST-segment elevation or left bundle branch block: GRACE (global registry of acute coronary events). J.A.C.C. Cardiovasc. Interv. 2009; 2: 26–33.
61. Latif F., Kleiman N., Cohen D.J. et al. In-hospital and 1-year outcomes among percutaneous coronary intervention patients with chronic kidney disease in the era of drug-eluting stents: a report from the EVENT (evaluation of drug-eluting stents and ischemic events) registry. JACC Cardiovasc. Interv. 2009; 2: 37–45.
62. Charytan D., Mauri L., Agarwal A. et al. The use of invasive cardiac procedures after acute myocardial infarction in long-term dialysis patients. Am. Heart J. 2006; 152: 558–564.
63. Herzog CA. Dismal long-term survival of dialysis patients after acute myocardial infarction: can we alter the outcome? Nephrol. Dial. Transpl. 2002; 17: 7–10.
64. Dragu R., Behar S., Sandach A. et al. Should primary percutaneous coronary intervention be the preferred method of reperfusion therapy for patients with renal failure and ST-elevation acute myocardial infarction? Am. J. Cardiol. 2006; 97: 1142–1145.
65. Keeley E.C., Kadakia R., Soman S. et al. Analysis of long-term survival after revascularization in patients with chronic kidney disease presenting with acute coronary syndromes. Am. J. Cardiol 2003; 92: 509–514.
Об авторах / Для корреспонденции
Арутюнов Г.П. – профессор, проректор по лечебной работе, заведующий кафедрой терапии Московского факультета РГМУ, д.м.н.
E-mail: arut@ossn.ru;
Оганезова Л.Г. – ассистент кафедры терапии Московского факультета РГМУ, к.м.н.
E-mail: lianaogan@gmail.com
Похожие статьи
- Поражение почек при рабдомиолизе, вызванном физической нагрузкой у людей молодого возраста
- ПРИЗНАКИ, ИМИТИРУЮЩИЕ АКТИВНОСТЬ ХРОНИЧЕСКОГО ГЛОМЕРУЛОНЕФРИТА
- Дисфункция почек – предиктор прогноза больных острым инфарктом миокарда с подъемом сегмента ST на ЭКГ
- Клиренс креатинина в долгосрочном прогнозировании риска сердечно-сосудистой смерти у больных острым коронарным синдромом без подъемов сегмента ST
- Тромботическая микроангиопатия, ассоциированная со злокачественной артериальной гипертензией
Источник
Инфаркт почки – это редкое нефрологическое заболевание, обусловленное эмболией артериальных сосудов органа с последующим некрозом его тканей и нарушением функциональной активности. Симптомы зависят от объема поражения, варьируются от полного отсутствия проявлений до резких болей в пояснице, гематурии, почечной недостаточности, увеличения уровня артериального давления. Диагностика производится на основании данных анамнеза, результатов анализов крови и мочи, УЗДГ сосудов почки, почечной ангиографии. Лечение преимущественно симптоматическое, также включает в себя применение антиагрегантных и антикоагулянтных средств, иногда показано хирургическое вмешательство.
Общие сведения
Инфаркт почки встречается намного реже других ишемических расстройств органов мочевыделительной системы. Данное состояние практически никогда не является изолированным нарушением, а выступает в качестве осложнений других, преимущественно сердечно-сосудистых патологий. Точные статистические данные относительно встречаемости болезни отсутствуют, поскольку определенная доля больных не обращается к специалистам из-за слабой выраженности симптомов.
Заболевание следует дифференцировать с мочекислым инфарктом почек у детей, являющимся одним из этапов адаптации мочевыделительной системы к внеутробному существованию. Из-за особенностей эпидемиологии болезней, способных осложняться инфарктом почки, патология чаще возникает у лиц старшего возраста, страдающих ожирением и обменными нарушениями.

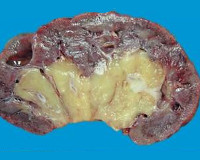
Инфаркт почки
Причины
В подавляющем большинстве случаев состояние имеет ишемический характер и вызывается эмболией магистральных почечных сосудов. Чаще всего эмбол представлен тромботическим сгустком, реже в таком качестве могут выступать фрагменты атеросклеротических бляшек, жировые массы. Картину, схожую с эмболией ветвей почечной артерии, иногда провоцируют артериовенозные фистулы или кровотечения. Таким образом, основной причиной заболевания является наличие в артериальной части большого круга кровообращения эмболов, которые могут образовываться при следующих патологиях:
- Эндокардит. Воспаление внутренней оболочки левого желудочка или предсердия часто осложняется формированием пристеночного тромба. Его фрагменты периодически попадают в большой круг кровообращения и могут закупоривать просвет артерий почек.
- Аритмии и пороки сердца. Различные нарушения сердечного ритма сопровождаются нарушениями гемодинамики внутри полостей сердца, что иногда приводит к тромбообразованию. Схожий механизм возникновения тромбов отмечается при недостаточности митрального клапана или пролапсе его створок.
- Атеросклеротическое поражение. Выраженный атеросклероз аорты или венечных артерий являются одной из наиболее частых причин инфаркта почки. Закупорка сосуда может быть обусловлена как фрагментом собственно атеросклеротической бляшки, так и тромбом, который образовался на ее поверхности. Атеросклероз почечных сосудов может приводить к расслоению их стенок, что также провоцирует закупорку просвета и острую ишемию.
- Узелковый периартериит. Данное состояние неясной этиологии в случае вовлечения в патологический процесс сосудистой сети почек может становиться причиной инфарктов.
- Медицинские манипуляции. Различные диагностические и лечебные манипуляции на органах мочевыделительной системы могут осложняться стенозом сосудов с развитием острой ишемии почечной ткани.
Косвенной причиной патологии иногда является наркотическая зависимость, связанная с частыми внутривенными вливаниями (опиоидная или эфедриновая наркомания). В случае использования нестерильного инструментария развивается специфический эндокардит с образованием многочисленных тромбов. Различные формы инфаркта почки обнаруживаются у 20-30% инъекционных наркоманов. Множественные очаги инфарктов в почечной ткани возникают и при диссеминированном внутрисосудистом свертывании крови (ДВС-синдроме).
Патогенез
Основополагающим звеном патогенеза более чем в 90% случаев инфаркта почки считается образование эмболов, которые вызывают закупорку сосудов органа. В результате нарушается снабжение участка почечной ткани кислородом и питательными веществами. По своей кислородной потребности почки уступают только нервной ткани и миокарду, из-за чего в результате ишемии довольно быстро возникают дистрофические изменения в клетках нефронов. Размер поражения зависит от калибра артериального сосуда, перекрытого эмболом – чем он больше, тем распространеннее зона инфаркта. Характерная форма зоны ишемии – клиновидная или треугольная с вершиной у ворот почки и обращенным к корковому веществу основанием. Это обусловлено особенностями распределения кровеносных сосудов в органе.
После прекращения поступления артериальной крови дистрофия клеток нефронов постепенно нарастает, сменяясь их гибелью и формированием участков некроза. Одновременно возникает раздражение юкстагломерулярного аппарата с образованием больших количеств гормона ангиотензина 2, что приводит к развитию вазоренальной гипертензии и каскаду связанных с этим нарушений (повышается риск инфаркта миокарда или инсульта). Продукты распада некротизированных тканей всасываются в системный кровоток и становятся причиной интоксикации организма, проявляющейся повышением температуры, головными болями, тошнотой. Исходом некроза становится разрастание фиброзной ткани и формирование рубца.
Симптомы инфаркта почки
Клиническая картина заболевания характеризуется различной выраженностью симптомов, которая, прежде всего, зависит от объема ишемизированной и некротизированной ткани почек. При незначительных инфарктах субъективные жалобы отсутствуют, патология выявляется случайно по измененным данным диагностических исследований. В случае более обширных поражений симптоматика становится выраженной, однако большинство проявлений неспецифичны – боль в пояснице, гематурия, уменьшение объема выделяемой мочи.
Болезненные ощущения, возникающие сначала с двух сторон, постепенно смещаются в сторону пораженной почки – двухсторонние инфаркты встречаются крайне редко. Интенсивность болевого синдрома иногда сопоставима с почечной коликой, боль устраняется только приемом сильных наркотических анальгетиков. Степень выраженности гематурии при инфаркте почки также может сильно варьироваться – от микроскопических количеств эритроцитов в моче до ее ярко алой окраски и профузного почечного кровотечения.
Иногда наблюдается реальная почечная колика, обусловленная прохождением кровяного сгустка или кусочка некротизированной ткани по мочевыводящим путям. Проявления почечной недостаточности обычно выражены слабо, особенно при сохраненной функциональной активности второй почки. При тотальном инфаркте возможно токсическое поражение парного органа, что проявляется развитием ОПН – анурией, запахом аммиака изо рта и от кожных покровов больного.
Общие симптомы заболевания сводятся к повышению температуры тела до 38 градусов, явлениям интоксикации (тошноте, рвоте, разбитому состоянию), ознобу. В некоторых случаях из-за нарушенного кровоснабжения почки возникает стимуляция юкстагломерулярного аппарата, провоцирующая рост артериального давления. Вышеперечисленные проявления обычно сочетаются с симптомами основной патологии, которая спровоцировала ишемию и инфаркт почечной ткани. Таковыми могут быть боли в области сердца, нарушения сердечного ритма, признаки циркуляторных расстройств при пороках клапанов (цианоз, повышение давления крови в малом круге кровообращения).
Осложнения
Ранним и наиболее тяжелым осложнением инфаркта почки является развитие острой почечной недостаточности. ОПН наблюдается достаточно редко, поскольку для этого необходимо наличие ряда условий – двухсторонний характер инфаркта либо наличие у больного только одной почки. При тотальной ишемии недостаточность может возникать из-за чрезмерной нагрузки на второй орган или по причине его токсического поражения. В отдаленной перспективе из-за формирования рубцов в пораженной почке снижается ее функциональная активность, что создает предпосылки для возникновения ХПН в будущем. У ряда больных после разрешения инфаркта сохраняется стойкое увеличение артериального давления, обусловленное нарушениями кровообращения в почках.
Диагностика
Определение инфаркта почки осложняется неспецифичностью симптомов, поскольку боли в пояснице, ухудшение общего состояния, гематурия характерны и для иных нефрологических заболеваний. Во многих случаях врачу-нефрологу или урологу требуется кооперация с другими медицинскими специалистами (например, с кардиологом) для уточнения диагноза. Особую важность имеет скорость определения болезни, так как от своевременности лечебных мер зависит ее исход, а при неправильном лечении повышается риск развития осложнений. В числе диагностических мероприятий выделяют следующие группы методов:
- Опрос и общий осмотр. При опросе акцентируют внимание на субъективных симптомах и жалобах больного. Имеет значение выраженность и локализация болезненных ощущений, наличие или отсутствие расстройств мочеиспускания. В анамнезе определяют наличие сердечно-сосудистых, гематологических или иных заболеваний, способных спровоцировать ишемию тканей почки.
- Лабораторные исследования. В общем анализе мочи практически всегда определяется наличие эритроцитов – от выраженной макрогематурии до микроскопических примесей крови, часто возникает протеинурия. При биохимическом исследовании мочи специфическим признаком инфаркта является увеличение уровня лактатдегидрогеназы (ЛДГ), аналогичное повышение наблюдается и в сыворотке крови. У большинства пациентов также обнаруживается незначительный лейкоцитоз, изменяются показатели коагулограммы – последняя выполняется для оценки необходимости использования антикоагулянтов.
- Инструментальные исследования. Обычно при подозрении на инфаркт почки производят ультразвуковую допплерографию (УЗДГ почечных артерий), позволяющую оценить показатели кровотока в основных сосудах органа. Еще больше информации дает селективная контрастная почечная ангиография, по результатам которой выявляется участок ишемизированной ткани, не накапливающей контраст. Как альтернативу последнему исследованию могут назначать МСКТ или МРТ с контрастом и последующим 3Д-моделированием почечной сосудистой сети.
- Эндоскопические исследования. Цистография при данном заболевании производится с целью дифференциальной диагностики. С помощью этого метода исключается вероятность кровотечения из мочевого пузыря (наблюдаемого при опухолях, травмах), уточняется односторонний характер поражения.
Дифференциальную диагностику инфаркта почки проводят с опухолевыми поражениями мочевыводящих путей (чашечно-лоханочной системы, мочеточников, мочевого пузыря и уретры) и кровотечениями из них. Иногда проявления заболевания создают ложную клиническую картину гломерулонефрита – он исключается при подтверждении одностороннего характера процесса и наличии ишемизированного участка тканей. При помощи дополнительных исследований инфаркт почки дифференцируют с почечной коликой при мочекаменной болезни и расслоением стенки брюшной аорты.
Лечение инфаркта почки
Основные цели терапии данного заболевания изменяются в зависимости от этапа патологического процесса. На начальных этапах первоочередной задачей является восстановление адекватного кровотока в органах выделения, что позволяет минимизировать негативные последствия ишемии. В дальнейшем на первый план выступает устранение кровотечения (макрогематурии), явлений общей интоксикации и сохранение функциональности оставшейся части органа. Зачастую для этих целей используют препараты с противоположным действием (например, антикоагулянты и гемостатики), поэтому от специалиста требуется особая осторожность при их назначении. Консервативная терапия инфаркта сводится к использованию следующих лекарственных средств:
- Обезболивающие препараты. Боли могут быть очень интенсивными, в ряде случаев болевой синдром устраняется только мощными наркотическими анальгетиками – морфином, фентанилом и другими.
- Тромболитические средства. К ним относят стрептокиназу и другие препараты данной группы, цель их применения – устранение тромба в сосуде, восстановления адекватного кровотока. Медикаменты используются только на первых этапах заболевания, до развития выраженной гематурии. После начала выделения крови с мочой назначение этих средств строго запрещено.
- Гемостатические препараты. Применяются при выраженной гематурии и профузном почечном кровотечении. Основным лекарственным средством данной группы является этамзилат натрия, введение которого позволяет минимизировать кровопотерю и улучшить прогноз заболевания.
- Антикоагулянты. На любом этапе патологии рекомендуется принимать меры по нормализации работы свертывающей системы крови, с этой целью назначаются антикоагулянты прямого действия (например, гепарин). Схема, дозировки и длительность применения строго индивидуальны, определяются после изучения коагулограммы больного.
- Антиагрегантные средства. Антиагреганты (например, ацетилсалициловая кислота) редко используются в остром периоде заболевания. Их назначают через 1-2 недели после исчезновения гематурии для снижения риска рецидива и отдаленных осложнений. Дозировка и длительность курса лечения определяется с учетом функциональной активности выделительной системы.
В тяжелых случаях (например, тотальный инфаркт почки) проводят хирургическое лечение, которое на начальных стадиях болезни сводится к восстановлению проходимости магистральных артерий и почечного кровотока. При поздней диагностике и развитии некротических изменений в почке по показаниям осуществляют оперативное удаление зоны инфаркта вплоть до нефрэктомии (при наличии у больного второго здорового органа). В числе вспомогательных лечебных мероприятий используют гемодиализ (при почечной недостаточности), назначают диуретические, гипотензивные и другие средства по показаниям.
Прогноз и профилактика
Прогноз инфаркта почки определяется объемом пораженных тканей – обычно страдает относительно небольшой фрагмент органа, после рубцевания это слабо отражается на работе выделительной системы. При ишемии значительной области органа возможно развитие острой или хронической почечной недостаточности, кровотечения и прочих жизнеугрожающих состояний. Существует риск рецидива, особенно при сохранении провоцирующего фактора (эндокардитов, пороков сердца, атеросклероза магистральных сосудов).
Поскольку заболевание часто является осложнением болезней сердечно-сосудистой системы, его профилактика заключается в правильном лечении основной патологии – использовании антиагрегантных средств, антибиотиков при эндокардитах, антихолестеринемических средств в случае атеросклероза.
Источник
