Инфаркт миокарда ферменты в крови

Для постановки диагноза инфаркта миокарда требуется сочетание типичной боли в сердце (затянувшийся приступ стенокардии), изменений на ЭКГ и анализа крови на ферменты. Кардиоспецифическими являются МВ-фракция креатинфосфокиназа, лактатдегидрогеназа, тропонин, соотношение аминотрасфераз. Этот метод является вспомогательным, он позволяет косвенным образом оценить размер разрушения миокарда и составить прогноз для выздоровления.
Изменение показателей крови при инфаркте
Из-за острого прекращения кровоснабжения сердечной мышцы в организме формируется ответная реакция. Она связана с такими процессами:
- разрушение мышечных клеток;
- проникновение продуктов распада в кровь;
- формирование воспаления вокруг очага инфаркта.
Поэтому, наряду со сбором жалоб, осмотром и аускультацией, ЭКГ, пациентам в обязательном порядке назначается клинический анализ крови и тест на выявление кардиоспецифических ферментов.
Основные лабораторные показатели зависят от обширности повреждения миокарда, наиболее характерными признаками являются:
- повышение содержания лейкоцитов (с первого дня до 7 — 10);
- резкое падение количества эозинофилов;
- незначительное смещение лейкоцитарной формулы влево;
- нарастание СОЭ (через 2 — 4 дня до 2 — 4 недели и дольше).
Эти данные не относятся к специфичным, так как они отражают степень воспалительной реакции на распад мышечной ткани. Поэтому их используют для косвенного определения степени тяжести инфаркта.
Рекомендуем прочитать о заднебазальном инфаркте. Вы узнаете о причинах возникновения, симптомах и диагностике, а также о лечении заднебазального инфаркта миокарда.
А здесь подробнее о лабораторной диагностике инфаркта миокарда.
Какие ферменты считаются кардиоспецифическими
К типичному симптому разрушения миокарда относится нарастание содержания ферментов, они названы кардиоспецифическими, так как содержатся преимущественно в клетках сердца. Для подтверждения диагноза используют ряд тестов, полученные результаты вместе с признаками ЭКГ и характерной болью в сердце составляют классическую триаду острого инфаркта миокарда
Креатинфосфокиназа
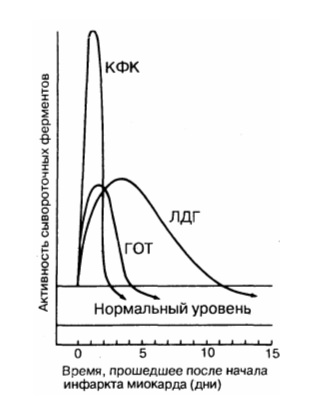
Этот фермент содержится в любой мышечной ткани, головном мозге и в клетках щитовидной железы. Поэтому для того, чтобы исключить ошибку при подозрении на некроз сердечной мышцы, исследуют его фракцию МВ. Она возрастает в первые часы после начала инфаркта и достигает пика через 10 часов, после 2-х суток возвращается к физиологическому уровню. Чем больше ее обнаруживают в крови, тем больше зона разрушения.
Лактатдегидрогеназа
Повышается медленнее, чем креатинфосфокиназа, и дольше теряет активность. Наивысшие значения появляются к концу второго дня после тяжелого приступа стенокардии, нормализация происходит к 9 — 10 дню, иногда остается повышенной до двух недель. Причинами нарастания содержания этого фермента также могут быть:
- болезни печени;
- шоковые состояния;
- застой крови при недостаточности кровообращения;
- разрушение эритроцитов;
- воспаления, в том числе и миокардит;
- тромбоэмболия легочных сосудов.
В связи с этим более точно отражает процесс некроза миокарда изофермент – лактатдегидрогеназа 1.
Аспартатаминотранфераза (АсАТ)
Повышается до максимума через сутки или 36 часов, а к концу первой недели возвращается к исходным значениям. Вместе с аланинаминотрасферазой (АлАТ) может увеличиваться при других заболеваниях, в том числе и при патологических изменениях в печени. Поэтому правильнее определять соотношение между этими соединениями – при инфаркте АсАТ/АлАТ превышает 1,33.
Тропонин
Относится к маркеру разрушения поперечнополосатых мышц. Его компонентами являются следующие виды белков: С (связывает кальций), Т (способствует соединению тропомиозина), I (тормозит С и Т). При этом тропонин Т и I находятся в типичных для сердечных клеток формах, что и позволяет их считать абсолютно кардиоспецифическими.
Тропонины появляются спустя 4 часа после образования зоны распада в миокарде и доходят до пика в первые сутки, их можно обнаружить на 7 — 14 день после приступа.
Тест на тропонин является достоверным критерием. На основании большого количества исследований доказано, что появление высокого уровня этого соединения является признаком острого инфаркта, а низкое содержание бывает при нестабильной стенокардии. Этот анализ используют для таких целей:
- установление диагноза в период до 2 недель;
- проведение дифференциальной диагностики со стенокардией;
- оценка размера некроза сердечной мышцы;
- определение прогноза и степени риска осложнений;
- исследование результативности терапии.
Миоглобин
Этот белок отвечает за транспорт кислорода в клетки сердца. Его можно обнаружить не только в миокарде, но и в других мышечных волокнах. Он повышается одним из первых при инфаркте – чаще всего это интервал между 4 и 6 часом после начала острой боли в сердце. Такое нарастание содержания в крови продолжается всего 3 — 4 часа, поэтому его легко пропустить, если не проводить мониторинговые исследования.
Поэтому данный показатель не всегда отражает истинное состояние сердца, а также не удается связать его концентрацию со степенью разрушения клеток.
Как правильно оценить полученные результаты
Для того, чтобы сориентироваться в наличии инфаркта миокарда, а также оценить его величину и давность развития, требуется определить различные показатели, проанализировать сочетание их изменений.
Могут быть следующие клинические ситуации:
- пациент госпитализирован в первые сутки от начала острой боли – нужен анализ МВ-креатинфосфокиназы, даже если на ЭКГ однозначно есть инфаркт, так как можно оценить размер некроза и составить прогноз. Нормальные значения не исключают инфаркт, нужно повторить исследование через сутки;
- больной поступил в период между 1 и 15 днем от начала приступа – проводится исследование лактатдегидрогеназы и соотношения АсАТ/АлАТ;
- если нет типичной боли в сердце и нормальная ЭКГ, то повышения ферментов для постановки диагноза недостаточно;
- рост содержания любого фермента не строго специфичен, но с большей долей вероятности на инфаркт указывает МВ-фракция креатинфосфокиназы и тропонин;
- нормальные показатели крови не исключают формирование острого инфаркта сердечной мышцы.
Рекомендуем прочитать о коронарной недостаточности. Вы узнаете о причинах появления и симптомах заболевания, а также о методах диагностики и лечения коронарной недостаточности.
А здесь подробнее об инфаркте правого желудочка.
Рост кардиоспецифических ферментов в крови связан с разрушением клеток сердца в период развития инфаркта миокарда. Каждый из показателей имеет свою динамику повышения и восстановления исходного уровня. Наиболее характерными именно для мышцы сердца являются МВ-фракция креатинфосфокиназы и компоненты тропонинового комплекса.
При нормальных показателях инфаркт не исключен, а на основании гиперферментемии диагноз не ставится, поэтому анализ крови оценивают только параллельно с клиническими симптомами и электрокардиографическими данными.
Полезное видео
Смотрите на видео о диагностике и лечении инфаркта миокарда:
Источник
Оглавление темы “Лабораторная диагностика инфаркта миокарда.”:
Лабораторные методы диагностики инфаркта миокарда. Ферменты инфаркта миокарда.Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ. Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза: • тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода).
• изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК); • суммарная КФК (норма – 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза. Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных. В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q.
Видео урок изменений в анализе крови при инфаркте миокардаПри проблемах с просмотром скачайте видео со страницы Здесь – Также рекомендуем “Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.” |
Источник
Стенокардия напряжения характеризуется преходящими приступами загрудинной боли, вызываемой физической или эмоциональной нагрузкой либо другими факторами, ведущими к повышению метаболических потребностей миокарда (повышение АД, тахикардия). В типичных случаях стенокардии напряжения появившаяся во время физической или эмоциональной нагрузки загрудинная боль (тяжесть, жжение, дискомфорт) обычно иррадиирует в левую руку, лопатку. Довольно редко локализация и иррадиация болей бывают атипичными. Приступ стенокардии длится от 1 до 10 мин, иногда до 30 мин, но не более. Боль, как правило, быстро купируется после прекращения нагрузки или через 2-4 мин после сублингвального приёма (под язык) нитроглицерина.
Впервые возникшая
стенокардия напряжения разнообразна по проявлениям и прогнозу поэтому не может быть с уверенностью отнесена к разряду стенокардии с определённым течением без результатов наблюдения за больным в динамике. Диагноз устанавливается в период до 3 месяцев со дня возникновения у больного первого болевого приступа. За это время определяется течение стенокардии: её схождение на нет, переход в стабильную либо прогрессирующую [15] .
Диагноз стабильной стенокардии
напряжения устанавливают в случаях устойчивого по течению проявления болезни в виде закономерного возникновения болевых приступов (или изменений ЭКГ, предшествующих приступу) на нагрузку определённого уровня за период не менее 3 месяца. Тяжесть стабильной стенокардии напряжения характеризует пороговый уровень переносимой больным физической нагрузки, по которому определяют функциональный класс её тяжести, обязательно указываемый в формулируемом диагнозе.
Прогрессирующая стенокардия
напряжения характеризуется относительно быстрым нарастанием частоты и тяжести болевых приступов при снижении толерантности к физической нагрузке. Приступы возникают в покое или при меньшей, чем раньше, нагрузке, труднее купируются нитроглицерином (нередко требуется повышение его разовой дозы), иногда купируются только введением наркотических анальгетиков.
Спонтанная стенокардия отличается от стенокардии напряжения тем, что болевые приступы возникают без видимой связи с факторами, ведущими к повышению метаболических потребностей миокарда. Приступы могут развиваться в покое без очевидной провокации, часто ночью или в ранние часы, иногда имеют циклический характер. По локализации, иррадиации и продолжительности, эффективности нитроглицерина приступы спонтанной стенокардии мало отличаются от приступов стенокардии напряжения.
Вариантной стенокардией
, или
стенокардией Принцметала
, обозначают случаи спонтанной стенокардии, сопровождающиеся преходящими подъёмами на ЭКГ сегмента SТ.
Инфаркт миокарда
Такой диагноз устанавливают при наличии клинических и (или) лабораторных (изменение активности ферментов) и электрокардиографических данных, свидетельствующих о возникновении очага некроза в миокарде, крупного или мелкого. Если в случае возникновения инфаркта больной не будет в максимально короткие сроки госпитализирован в ОРИТ, возможно развитие тяжелых осложнений и велика вероятность летального исхода.
Крупноочаговый (трансмуральный)
инфаркт миокарда обосновывается патогномоничными изменениями ЭКГ или специфическим повышением активности ферментов в сыворотке крови (определённых фракций креатинфосфокиназы, лактатдегидрогеназы и др.) даже при нетипичной клинической картине.
Перечисленные ферменты — это ферменты окислительно-восстановительных реакций. В нормальных условиях они обнаруживаются только внутри клетки. Если клетка разрушается (например, при некрозе), то эти ферменты высвобождаются и определяются лабораторно. Увеличение концентраций этих ферментов в крови при инфаркте миокарда получило название резорбционно-некротического синдрома [16] .
Диагноз мелкоочагового
инфаркта миокарда ставится при развивающихся в динамике изменениях сегмента SТ или зубца Т без патологических изменений комплекса QRS, но при наличии типичных изменений активности ферментов.
Не нашли то, что искали? Воспользуйтесь поиском:
Отключите adBlock! и обновите страницу (F5) очень нужно
- сердце
- сосуды
- вены
Что такое ферменты сердца и показания к проведению исследования
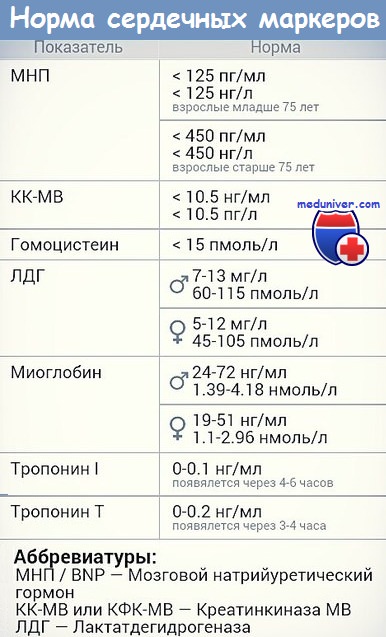
Ферменты сердца – это особые вещества, содержание которых в крови тесно связано с повреждениями сердца. Ферменты креатинкиназа и креатинфосфокиназа, белки тропонин I и тропонин Т – основные показатели анализа на ферменты сердца. При повреждении сердца они попадают в кровь, т.е. их содержание повышается. Результаты анализа на ферменты сердца всегда сопоставляются с вашими симптомами и результатами ЭКГ.
Ферменты сердца измеряются для того, чтобы:
- Определить риск сердечного приступа, если у вас боли в груди, одышка, рвота, повышенное потоотделение и аномальная кардиограмма;
- Проверить успешность шунтирования сердца;
- Следить за ходом лечения закупорки сосудов и других болезней сердца.
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
Изоферменты креатинкиназы | Изоферменты лактатдегидрогеназы |
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. Изоферменты ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
Что может помешать анализу на ферменты сердца?
Причины, по которым анализ на сердечные ферменты может быть неточным:
- Аутоиммунные болезни и мышечная дистрофия;
- Миокардит и другие болезни сердца;
- Внутримышечные препараты;
- Препараты, понижающие уровень холестерина;
- Злоупотребление алкоголем;
- Почечная недостаточность;
- Недавно перенесённая операция или серьёзная травма;
- Активные занятия спортом;
- Кардиостимуляция электрошоком, дефибрилляция и другие чрезвычайные меры.
Другой белок, миоглобин, может измеряться одновременно с сердечными ферментами.
Для постановки диагноза инфаркта миокарда требуется сочетание типичной боли в сердце (затянувшийся приступ стенокардии), изменений на ЭКГ и анализа крови на ферменты. Кардиоспецифическими являются МВ-фракция креатинфосфокиназа, лактатдегидрогеназа, тропонин, соотношение аминотрасфераз. Этот метод является вспомогательным, он позволяет косвенным образом оценить размер разрушения миокарда и составить прогноз для выздоровления.
Читайте в этой статье
Изменение показателей крови при инфаркте
Из-за острого прекращения кровоснабжения сердечной мышцы в организме формируется ответная реакция. Она связана с такими процессами:
- разрушение мышечных клеток;
- проникновение продуктов распада в кровь;
- формирование воспаления вокруг очага инфаркта.
Поэтому, наряду со сбором жалоб, осмотром и аускультацией, ЭКГ, пациентам в обязательном порядке назначается клинический анализ крови и тест на выявление кардиоспецифических ферментов.
Основные лабораторные показатели зависят от обширности повреждения миокарда, наиболее характерными признаками являются:
- повышение содержания лейкоцитов (с первого дня до 7 — 10);
- резкое падение количества эозинофилов;
- незначительное смещение лейкоцитарной формулы влево;
- нарастание СОЭ (через 2 — 4 дня до 2 — 4 недели и дольше).
Эти данные не относятся к специфичным, так как они отражают степень воспалительной реакции на распад мышечной ткани. Поэтому их используют для косвенного определения степени тяжести инфаркта.
А здесь подробнее о лабораторной диагностике инфаркта миокарда.
Какие ферменты считаются кардиоспецифическими
К типичному симптому разрушения миокарда относится нарастание содержания ферментов, они названы кардиоспецифическими, так как содержатся преимущественно в клетках сердца. Для подтверждения диагноза используют ряд тестов, полученные результаты вместе с признаками ЭКГ и характерной болью в сердце составляют классическую триаду острого инфаркта миокарда
Этот фермент содержится в любой мышечной ткани, головном мозге и в клетках щитовидной железы. Поэтому для того, чтобы исключить ошибку при подозрении на некроз сердечной мышцы, исследуют его фракцию МВ. Она возрастает в первые часы после начала инфаркта и достигает пика через 10 часов, после 2-х суток возвращается к физиологическому уровню. Чем больше ее обнаруживают в крови, тем больше зона разрушения.
Повышается медленнее, чем креатинфосфокиназа, и дольше теряет активность. Наивысшие значения появляются к концу второго дня после тяжелого приступа стенокардии, нормализация происходит к 9 — 10 дню, иногда остается повышенной до двух недель. Причинами нарастания содержания этого фермента также могут быть:
- болезни печени;
- шоковые состояния;
- застой крови при недостаточности кровообращения;
- разрушение эритроцитов;
- воспаления, в том числе и миокардит;
- тромбоэмболия легочных сосудов.
В связи с этим более точно отражает процесс некроза миокарда изофермент – лактатдегидрогеназа 1.
Повышается до максимума через сутки или 36 часов, а к концу первой недели возвращается к исходным значениям. Вместе с аланинаминотрасферазой (АлАТ) может увеличиваться при других заболеваниях, в том числе и при патологических изменениях в печени. Поэтому правильнее определять соотношение между этими соединениями – при инфаркте АсАТ/АлАТ превышает 1,33.
Относится к маркеру разрушения поперечнополосатых мышц. Его компонентами являются следующие виды белков: С (связывает кальций), Т (способствует соединению тропомиозина), I (тормозит С и Т). При этом тропонин Т и I находятся в типичных для сердечных клеток формах, что и позволяет их считать абсолютно кардиоспецифическими.
Тропонины появляются спустя 4 часа после образования зоны распада в миокарде и доходят до пика в первые сутки, их можно обнаружить на 7 — 14 день после приступа.
Тест на тропонин является достоверным критерием. На основании большого количества исследований доказано, что появление высокого уровня этого соединения является признаком острого инфаркта, а низкое содержание бывает при нестабильной стенокардии. Этот анализ используют для таких целей:
- установление диагноза в период до 2 недель;
- проведение дифференциальной диагностики со стенокардией;
- оценка размера некроза сердечной мышцы;
- определение прогноза и степени риска осложнений;
- исследование результативности терапии.
Этот белок отвечает за транспорт кислорода в клетки сердца. Его можно обнаружить не только в миокарде, но и в других мышечных волокнах. Он повышается одним из первых при инфаркте – чаще всего это интервал между 4 и 6 часом после начала острой боли в сердце. Такое нарастание содержания в крови продолжается всего 3 — 4 часа, поэтому его легко пропустить, если не проводить мониторинговые исследования.
Поэтому данный показатель не всегда отражает истинное состояние сердца, а также не удается связать его концентрацию со степенью разрушения клеток.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
Схема формирования сложного фермента
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором (или эффектором, модулятором, регулятором), вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Как правильно оценить полученные результаты
Для того, чтобы сориентироваться в наличии инфаркта миокарда, а также оценить его величину и давность развития, требуется определить различные показатели, проанализировать сочетание их изменений.
Могут быть следующие клинические ситуации:
- пациент госпитализирован в первые сутки от начала острой боли – нужен анализ МВ-креатинфосфокиназы, даже если на ЭКГ однозначно есть инфаркт, так как можно оценить размер некроза и составить прогноз. Нормальные значения не исключают инфаркт, нужно повторить исследование через сутки;
- больной поступил в период между 1 и 15 днем от начала приступа – проводится исследование лактатдегидрогеназы и соотношения АсАТ/АлАТ;
- если нет типичной боли в сердце и нормальная ЭКГ, то повышения ферментов для постановки диагноза недостаточно;
- рост содержания любого фермента не строго специфичен, но с большей долей вероятности на инфаркт указывает МВ-фракция креатинфосфокиназы и тропонин;
- нормальные показатели крови не исключают формирование острого инфаркта сердечной мышцы.
А здесь подробнее об инфаркте правого желудочка.
Рост кардиоспецифических ферментов в крови связан с разрушением клеток сердца в период развития инфаркта миокарда. Каждый из показателей имеет свою динамику повышения и восстановления исходного уровня. Наиболее характерными именно для мышцы сердца являются МВ-фракция креатинфосфокиназы и компоненты тропонинового комплекса.
При нормальных показателях инфаркт не исключен, а на основании гиперферментемии диагноз не ставится, поэтому анализ крови оценивают только параллельно с клиническими симптомами и электрокардиографическими данными.
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами «туннель». В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
Строение мульферментного комплекса
Например,
- пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-SКоА,
- α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА,
- комплекс под названием «синтаза жирных кислот» (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту
- карбамоилфосфатсинтетаза, первый фермент синтеза мочевины в печени и синтеза пиримидиновых оснований
Источник