Инфаркт это какой некроз
Август 22, 2018
Нет комментариев
Некротические повреждения сердечной мышцы, т. е. гибель участков миокарда, бывают связаны или не связаны с нарушением коронарного кровообращения. В зависимости от этого они подразделяются на коронарогеннш и некоронарогенные некрозы.

Коронарогенные (ишемические) некрозы миокарда
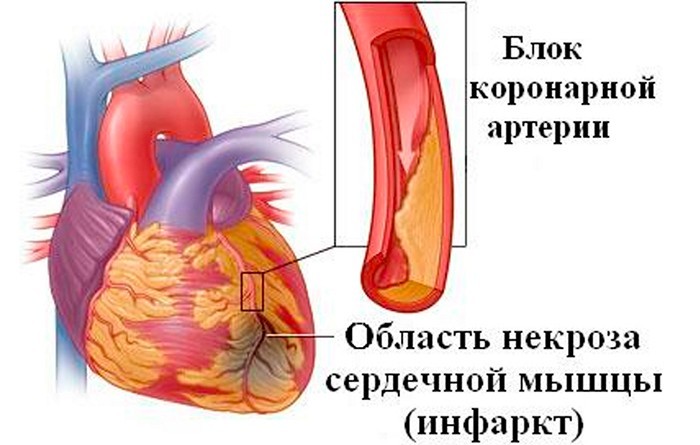
Некроз миокарда, возникающий вследствие ухудшения коронарного кровотока (ишемии), называется инфарктом миокарда.
Некроз инфаркт миокарда
представляет собой одну из острых форм ИБС, при которой доставка к сердцу кислорода и питательных веществ не удовлетворяет потребности сердца в этих веществах.
Этиология
В этиологии инфаркта миокарда играют важную роль атеросклероз коронарных артерий, их тромбоз, спазм и (достаточно редко) эмболия коронарных артерий. К факторам риска инфаркта миокарда можно отнести все те, которые указаны как факторы риска ИБС (см. начало данного раздела). Сочетание двух или трех факторов риска увеличивает вероятность возникновения инфаркта миокарда.
Патогенез
Выделяют следующие последовательно развивающиеся стадии в патогенезе инфаркта миокарда.
1. Выключение дыхательной цепи митохондрий и активация гликолиза как следствие начавшейся ишемии. Накопление недоокисленных продуктов метаболизма (прежде всего молочной кислоты) обусловливает появление боли.
2. Ингибирование основных метаболических путей, подавление гликолиза (из-за слишком большого снижения pH в ткани миокарда) и цикла Кребса, вследствие чего развивается дефицит аденозинтрифосфата. Наблюдается накопление жирных кислот вследствие угнетения их р. окисления, а также нарушение ионного равновесия в кардиомиоцитах
3. Разрушение мембран кардиомиоцитов в результате включения в патогенез инфаркта так называемой липидной триады. В нее входят активация липаз и фосфолипаз, активация свободнорадикального перекисного окисления липидов и детергентное действие на миокард избытка жирных кислот. Все указанные изменения происходят в мембранах сарколеммы, лизосом, саркоплазматического ретикулума и митохондрий и приводят к их повреждению и повышению проницаемости. Следствием этого является выход аутолитических ферментов лизосом в клетки миокарда, а также накопление в них избытка свободного Са++. Избыток Са++ вызывает контрактуру миофибрилл и приводит к дальнейшей активации липаз и фосфолипаз.
4. Заключительная стадия необратимых повреждений кардиомио-цитов и некроз ишемического участка миокарда.
Клинические проявления
Основными клиническими симптомами инфаркта миокарда являются:
1. Локализующаяся за грудиной сильнейшая боль, иррадиирующая в левое плечо, левую руку и межлопаточную область. Эта боль может возникать в покое днем или в ночное время.
В отличие от приступа стенокардии болевой синдром при инфаркте миокарда длится дольше и не купируется повторным приемом нитроглицерина. Следует отметить, что в тех случаях, когда болевой приступ длится более 15 мин, а принимаемые меры неэффективны, необходимо немедленно вызвать бригаду скорой медицинской помощи.
Встречаются и атипичные формы инфаркта миокарда, при которых характерные симптомы, в частности болевой синдром, могут отсутствовать (безболевая форма инфаркта миокарда).
2. Ослабление сократительной способности миокарда вследствие выпадения из акта сокращения поврежденного участка миокарда ведет к уменьшению сердечного выброса. При этом в зоне некроза с помощью эхокардиографии могут выявляться различные нарушения движения стенки поврежденного желудочка: акинезия, гипокинезия, дискинезия (выбухание участка инфаркта в момент систолы). Последнее может свидетельствовать о формировании острой аневризмы сердца-
3. Аритмии. В связи с изменением в зоне инфаркта биоэлектрических свойств кардиомиоцитов возникают нарушения сердечного ритма (вплоть до развития фибрилляции сердца), что приводит к значительным расстройствам системной гемодинамики и усугубляет нарушение контрактильной функции сердца. Источником эктопической активности на ранних стадиях развития инфаркта служит, как правило, окржающая зону некроза так называемая паранекротическая зона.
4. Появление типичных изменений ЭКГ. К ним относятся смещение сегмента ST выше или ниже относительно изоэлектрической линии, появление патологического комплекса QS (свидетельствует о наличии в миокарде очага глубокой ишемии или некроза), а также появление гигантского зубца Т. Он может быть положительным или отрицательным. Если подобный зубец Т появляется в раннем периоде инфаркта миокарда, его трактуют (как и смещение сегмента ST) как проявление острой ишемии миокарда. Если же он появляется на поздних стадиях, его связывают с формированием в миокарде рубцовых изменений.
В зависимости от особенностей изменений ЭКГ различают следующие формы инфаркта миокарда:
• Q-образующий инфаркт, или Q-инфаркт (с формированием патологического глубокого зубца Q, что может свидетельствовать о крупноочаговом трансмуральном инфаркте);
• Q-необразующий инфаркт, или He-Q-инфаркт (сопровождается не появлением зубца Q, а появлением отрицательного зубца Т, что свидетельствует о мелкоочаговом инфаркте миокарда).
5. В крови повышается содержание так называемых маркеров инфаркта миокарда: миокардиальной фракции креатинфосфокиназы, миоглобина, а также тропонина-Т, который имеет на сегодняшний день наиболее важное значение в диагностике инфаркта миокарда.
6. Одно из важных проявлений инфаркта миокарда – ухудшение реологических свойств крови, что способствует тромбообразованию. При инфаркте миокарда венозный тромбоз диагностируется у 10-15 % больных.
7. Кроме описанных выше изменений могут наблюдаться расстройства мозгового кровообращения, нарушения функции желудочно-кишечного тракта. Через несколько часов от начала инфаркта миокарда развивается лейкоцитоз. Весьма характерно для инфаркта появление так называемого симптома перекреста между числом лейкоцитов в крови и СОЭ, когда в конце 1-й недели выраженность лейкоцитоза снижается, а СОЭ увеличивается.
Осложнения
К ранним осложнениям относят острую сердечную недостаточность, кардиогенный шок, отек легких, механические осложнения (разрыв папиллярных мышц, перегородки и стенок миокарда), тампонаду сердца, перикардит, тромбоэмболию легочной артерии, являющуюся одной из наиболее частых причин внезапной смерти.
К поздним осложнениям (возникают через 2-3 нед. и более от начала инфаркта) относят постинфарктный синдром Дресслера, хроническую недостаточность кровообращения, развитие аневризм сердца, тромбоэмболию легочной артерии и повторные инфаркты миокарда. Что касается синдрома Дресслера, то он возникает через 2-6 нед. от начала инфаркта и проявляется перикардитом, плевритом и пневмонией. В его патогенезе играет роль образование аутоантител к деструктивно измененным при инфаркте белкам миокарда — миокардиальным аутоантигенам.
Принципы патогенетической терапии
1. Ликвидация болевого приступа с помощью сильнодействующих анальгетиков и наркотических средств.
2. Использование антиагрегантов и тромболитических препаратов. В качестве доврачебной помощи рекомендуется использовать аспирин.
3. Уменьшение потребности сердца в кислороде, улучшение его доставки и снижение риска возникновения аритмий ф-адреноблокаторы).
Рекомендуется также использовать:
• ингибиторы ангиотензинпревращающего фермента;
• седативные и снотворные препараты;
• противоаритмические средства.
4. Важное значение имеют и хирургические методы лечения, в частности аортокоронарное шунтирование и баллонная ангиопластика со стентированием коронарных артерий.
Некоронарогенные (неишемические) некрозы миокарда
Поражения сердца этого типа возникают как результат нарушения метаболизма в сердечной мышце в связи с действием на сердце избытка электролитов, гормонов, токсических продуктов обмена, кардиальных аутоантител. Различают следующие виды некоронарогенных некрозов миокарда.
Электролитно-стероидные некрозы
Образование данного вида некрозов связано с патогенным действием на миокард избытка вводимых в организм гормонов коры надпочечников (прежде всего минералокортикоидов) в сочетании с солями натрия. Такое воздействие приводит к увеличению проницаемости мембран кардиомиоцитов для натрия и накоплению его в сердце. Развивающийся впоследствии отек и «осмотический взрыв» клеток миокарда сопровождается возникновением очагов некроза.
Катехоламиновые некрозы миокарда
Повреждающее действие избыточных концентраций катехоламинов на сердце объясняется следующими механизмами.
Во-первых, сами катехоламины, и прежде всего адреналин, обладают прямым повреждающим действием на миокард.
Во-вторых, несмотря на то что катехоламины расширяют коронарные сосуды, они в значительно большей степени увеличивают потребность сердца в кислороде, т. к. повышают частоту сердечных сокращений и артериальное давление. Поэтому при прохождении крови по венечным сосудам кислород утилизируется раньше, чем кровь достигнет прекапиллярного отдела микрососудистого русла. Это приводит к тому, что в миокарде появляются участки, получающие кровь, обедненную кислородом.
В-третьих, под влиянием избытка катехоламинов в миокарде происходит активация перекисного окисления липидов, продукты которого повреждают мембраны кардиомиоцитов.
Токсические и воспалительные некрозы миокарда
Данные виды некрозов возникают при интоксикации или поражении миокарда воспалительным процессом. Токсический миокардит может возникать вследствие воздействия некоторых химических соединений и фармакологических препаратов, например кокаина, лекарственных средств, применяемых при лечении злокачественных опухолей. Эти токсические вещества оказывают прямое повреждающее действие на миокард, приводя к развитию необратимой дистрофии и появлению мелкоочаговых некрозов.
Примером воспалительных некрозов миокарда служат различные миокардиты: ревматические и дифтерийные. При любом воспалительном процессе, как и в данном случае, наблюдается альтерация (повреждение) миофибрилл. Развивающийся воспалительный отек также способствует альтерации. Все это ведет к развитию микронекрозов миокарда.
Аутоиммунные некрозы
Одним из примеров аутоиммунных некрозов миокарда служит синдром Дресслера, о котором было сказано выше.
Поврежденные белки при инфаркте миокарда могут стать аутоантигенами, к которым в организме вырабатываются антитела. Повторное развитие некротического процесса обусловливает запуск реакции «антиген-антитело» во многих участках сердечной мышцы, что вызывает множественные микронекрозы.
Загрузка…
Источник
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 октября 2019;
проверки требует 1 правка.
Перейти к навигации
Перейти к поиску
Компьютерная томограмма, демонстрирующая инфаркты селезёнки (белые стрелки).
Инфаркт передней стенки левого желудочка сердца.
Инфа́ркт (лат. infarcire «начинять, набивать») — омертвление (некроз) органа вследствие острого недостатка кровоснабжения[1]. Причины инфаркта: тромбоз, эмболия, длительный спазм артерий и функциональное перенапряжение органа в условиях гипоксии при недостаточности коллатерального кровообращения[2].
Термин применим ко всем метаболит-активным органам, однако наиболее часто в употреблении встречаются:
- инфаркт миокарда;
- инфаркт мозга (ишемический инсульт);
- инфаркт таламуса;
- инфаркт мышцы конечности;
- инфаркт почки;
- инфаркт селезёнки.
См. также[править | править код]
Воспроизвести медиафайл
Видео, описывающее механизм сердечных приступов. Английский с русскими субтитрами.
- Ишемия
- Инсульт
Примечания[править | править код]
- ↑ Инфаркт // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2.
- ↑ Инфаркт / Е. А. Коган // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
Литература[править | править код]
- Инфаркт — статья из Большой советской энциклопедии.
Это заготовка статьи по патологии. Вы можете помочь проекту, дополнив её. |
Для улучшения этой статьи желательно:
Пожалуйста, после исправления проблемы исключите её из списка параметров. После устранения всех недостатков этот шаблон может быть удалён любым участником. |
Источник — https://ru.wikipedia.org/w/index.php?title=Инфаркт&oldid=108204648
Категория:
- Инфаркт
Источник
Некроз (от греч. nekros – мертвый) – омертвение, гибель клеток и тканей в живом организме; при этом жизнедеятельность их полностью прекращается. Некротический процесс проходит ряд стадий, что позволяет говорить о морфогенезе некроза:
- паранекроз – подобные некротическим, но обратимые изменения;
- некробиоз – необратимые дистрофические изменения, характеризующиеся преобладанием катаболических реакций над анаболическими;
- смерть клетки, время наступления которой установить трудно;
- аутолиз – разложение мертвого субстрата под действием гидролитических ферментов погибших клеток и макрофагов.
В морфологическом выражении некроз равнозначен аутолизу. Своеобразной формой некроза является апоптоз (от греч. аро – разделение и ptosis – опущение, падение). В основе апоптоза лежат разделение клетки на части с образованием апоптозных тел (фрагменты клетки, окруженные мембраной и способные к жизнедеятельности) и последующий фагоцитоз этих тел макрофагами.
Некробиотические и некротические процессы (некроз, апоптоз) происходят постоянно как проявление нормальной жизнедеятельности организма, так как отправление любой функции требует затрат материального субстрата, восполняемых физиологической регенерацией. Кроме того, большая часть клеток организма постоянно подвергается старению, естественной смерти с последующим их разрушением путем апоптоза и физиологического аутолиза.
Таким образом, в организме постоянно совершаются процессы физиологической деструкции, т. е. некротические, аутолитические и восстановительные, т. е. репаративные, регенераторные процессы, что обеспечивает нормальную его жизнедеятельность.
Некроз возникает чаще и раньше в функционально-активных паренхиматозных структурах (функционально отягощенные отделы миокарда, проксимальные и дистальные отделы почек, нейроны головного мозга и т. д.). Некрозу могут подвергаться часть клетки, клетка, группа клеток, участок ткани, органа, целый орган или часть тела. Поэтому в одних случаях он определяется лишь при микроскопическом исследовании, в других – хорошо различим невооруженным глазом.
Микроскопические признаки некроза. К ним относятся характерные изменения клетки и межклеточного вещества. Изменения клетки касаются как ядра, так и цитоплазмы. Ядро сморщивается, при этом происходит конденсация хроматина – кариопикноз, распадается на глыбки – кариорексис и растворяется – кариолизис. Пикноз, рексис и лизис ядра являются последовательными стадиями процесса и отражают динамику активации гидролаз – рибонуклеазы и дезоксирибонуклеазы, что ведет к отщеплению от нуклеотидов фосфатных групп и высвобождению нуклеиновых кислот, которые подвергаются деполимеризации. В цитоплазме происходят денатурация и коагуляция белков, сменяемая обычно колликвацией, ультраструктуры ее погибают. Изменения могут охватывать часть клетки (фокальный коагуляционный некроз), которая отторгается, или всю клетку {коагуляция цитоплазмы). Коагуляция завершается плазморексисом – распадом цитоплазмы на глыбки. На заключительном этапе разрушение мембранных структур клетки ведет к ее гидратации, наступает гидролитическое расплавление цитоплазмы – плазмолиз. Расплавление в одних случаях охватывает всю клетку {цитолиз), в других – лишь часть ее (фокальный колликвационный некроз, или баллонная дистрофия). При фокальном некрозе может произойти полное восстановление наружной мембраны клетки. Изменения цитоплазмы (коагуляция, плазморексис, плазмолиз), так же как и изменения ядра клетки, являются морфологическим выражением ферментативного процесса, в основе которого лежит активация гидролитических ферментов лизосом.
Изменения межклеточного вещества при некрозе охватывают как межуточное вещество, так и волокнистые структуры. Межуточное вещество вследствие деполимеризации его гликозаминогликанов и пропитывания белками плазмы крови набухает и расплавляется. Коллагеновые волокна также набухают, пропитываются белками плазмы (фибрин), превращаются в плотные гомогенные массы, распадаются или лизируются. Изменения эластических волокон подобны описанным выше: набухание, базофилия, распад, расплавление – эластолиз. Ретикулярные волокна нередко сохраняются в очагах некроза длительное время, но затем подвергаются фрагментации и глыбчатому распаду; аналогичны изменения и нервных волокон. Распад волокнистых структур связан с активацией специфических ферментов – коллагеназы и эластазы. Таким образом, в межклеточном веществе при некрозе чаще всего развиваются изменения, характерные для фибриноидного некроза. Реже они проявляются резко выраженными отеком и ослизнением ткани, что свойственно колликвационному некрозу. При некрозе ж ировой ткани преобладают липолитические процессы. Происходит расщепление нейтральных жиров с образованием жирных кислот и мыл, что ведет к реактивному воспалению, образованию липогранулем (см. Воспаление).
Итак, в динамике некротических изменений, особенно клетки, существует смена процессов коагуляции и колликвации, однако нередко отмечается преобладание одного из них, что зависит как от причины, вызвавшей некроз, и механизма его развития, так и от структурных особенностей органа или ткани, в которых некроз возникает.
При распаде клеток и межклеточного вещества в очаге некроза образуется тканевый детрит. Вокруг очага некроза развивается демаркационное воспаление.
При некрозе тканей изменяются их консистенция, цвет, запах. В одних случаях мертвая ткань становится плотной и сухой (мумификация), в других – дряблой и расплавляется (миомаляция, энцефаломаляция от греч. malakas – мягкий). Мертвая ткань нередко бывает бледной и имеет бело-желтый цвет. Таковы, например, очаги некроза в почках, селезенке, миокарде при прекращении притока крови, очаги некроза при действии микобактерий туберкулеза. Иногда, напротив, она пропитана кровью, имеет темно-красный цвет. Примером могут служить возникающие на фоне венозного застоя очаги циркуляторного некроза в легких. Фокусы некроза кожи, кишечника, матки часто приобретают грязно-бурый, серо-зеленый или черный цвет, так как пропитывающие их кровяные пигменты претерпевают ряд изменений. В некоторых случаях фокусы некроза прокрашиваются желчью. При гнилостном расплавлении мертвая ткань издает характерный дурной запах.
Классификация. Учитываются причина, вызывающая некроз, механизм развития, клинико-морфологические особенности.
В зависимости от причины некроза различают следующие его виды; травматический, токсический, трофоневротический, аллергический, сосудистый.
Травматический некроз является результатом прямого действия на ткань физических или химических факторов. Такой некроз возникает при воздействии радиации, низких (отморожение) и высоких (ожог) температур, в краях раневого канала, при электротравме. Токсический некроз развивается в результате действия на ткани токсинов как бактериального, так и небактериального происхождения, химических соединений различной природы (кислоты, щелочи, лекарственные препараты, этиловый спирт и др.). Таков, например, некроз эпителия проксимального отдела нефрона при отравлении сулемой, некроз кардиомиоцитов при воздействии дифтерийного экзотоксина. Трофоневротический некроз возникает при нарушениях нервной трофики тканей. В результате этих нарушений развиваются циркуляторные расстройства, дистрофические и некробиотические изменения, завершающиеся некрозом. Таковы некрозы при заболеваниях и травмах центральной и периферической нервной системы (незаживающие язвы при повреждении периферических нервов). Примером трофоневротического некроза являются пролежни.
Аллергический некроз ткани наступает в сенсибилизированном организме и является, как правило, выражением реакций гиперчувствительности немедленного типа. Обычно это фибриноидный некроз, часто встречающийся при инфекционно-аллергических и аутоиммунных заболеваниях. Классическим примером аллергического некроза может служить феномен Артюса. Сосудистый некроз, который называют инфарктом, возникает при нарушении или прекращении кровотока в артериях вследствие тромбоза, эмболии, длительного спазма (антиогенный некроз). Недостаточный приток крови вызывает ишемию, гипоксию и гибель ткани вследствие прекращения окислительно-восстановительных процессов (ишемический некроз). В развитии сосудистого некроза большое значение имеет функциональное напряжение органа в условиях недостаточности коллатерального кровообращения при сужении просвета основных артерий, питающих орган. Таковы, например, ишемические некрозы миокарда в условиях функциональной нагрузки при стенозирующем атеросклерозе венечных (коронарных) артерий сердца.
Механизм развития. Механизмы возникновения некроза сложны и определяются характером патогенных факторов, структурно-функциональными особенностями ткани, в которой развивается некроз, реактивностью организма, наследственно-конституциональными факторами. В зависимости от механизма действия патогенного фактора различают прямой некроз, обусловленный непосредственным воздействием (травматический и токсический некрозы), и непрямой некроз, возникающий опосредованно через сосудистую и нервно-эндокринную системы (трофоневротический, аллергический, сосудистый некрозы).
Во внутриутробном периоде и в детском возрасте преобладает прямой некроз, связанный с непосредственным воздействием инфекционного агента или токсического вещества на ткани (множественные ареактивные некрозы внутренних органов и слизистых оболочек у плодов, новорожденных и недоношенных при генерализованной ветряной оспе, генерализованной оспенной вакцине, сепсисе, токсоплазмозе) или вследствие побочного токсического воздействия некоторых лекарственных препаратов (цитостатические средства, аминазин и др.). Непрямые некрозы, часто встречающиеся у взрослых, наблюдаются у детей в виде исключения при пороках развития сосудистого русла того или иного органа или нарушениях обмена электролитов.
Клинико-морфологические формы некроза выделяют, учитывая структурно-функциональные особенности органов и тканей, в которых возникает некроз, а также причины его возникновения и условия развития. Среди них различают коагуляционный некроз, колликвационный некроз, гангрену, секвестр, инфаркт.
Коагуляционный (сухой) некроз характеризуется тем, что возникающие при нем мертвые участки сухие, плотные, серо-желтого цвета. В основе сухого некроза лежат процессы денатурации белков с образованием труднорастворимых соединений, которые могут длительное время не подвергаться гидролитическому расщеплению, ткани при этом обезвоживаются. Условия для развития сухого некроза имеются прежде всего в тканях, богатых белками и бедных жидкостями. Примером могут служить восковидный, или ценкеровский (описан Ценкером), некроз мышц при инфекциях (брюшной и сыпной тифы), травме; творожистый некроз при туберкулезе, сифилисе, лепре, лимфогранулематозе; фибриноидный некроз при аллергических и аутоиммунных заболеваниях.
Источник
