Инфаркт и некроз отличия
Завершающим этапом повреждений тканей организма является их гибель. Однако сами повреждения связаны не только с патологическими процессами, возникающими в организме, но и со старением функционирующих биологических структур. Вместе с тем механизмы гибели клеток и тканей в условиях нормы и в условиях патологии значительно отличаются друг от друга и имеют разное морфологическое выражение.
АПОПТОЗ
Апоптоз — физиологическая гибель клеток в живом организме.
Общая характеристика.
Все ткани организма имеют свой срок жизни, после истечения которого и прекращения функции они должны погибнуть и на их месте появляются новые, аналогичные погибшим, клетки и ткани. Сроки жизни у разных живых структур различны. Они определены в их геноме, т. е. генетически запрограммированы. Поэтому апоптоз является генетически запрограммированной гибелью клеток. Это важнейший физиологический процесс, позволяющий организму постоянно сохранять функции своих структур на определенном уровне. Кроме того, в процессе образования новых клеток и внеклеточных структур возникают генетические ошибки, происходят мутации и появляются клетки, отличающиеся от клеток организма. Они должны быть немедленно уничтожены, и их гибель также осуществляется с помощью апоптоза, который является и механизмом генетического контроля синтеза веществ и клеток организма. Таким образом, апоптоз как физиологический процесс протекает непрерывно на протяжении всей жизни человека, и биологический смысл его заключается в поддержании постоянства клеток и тканей организма, т. е. тканевого гомеостаза. С помощью апоптоза происходит инволюция органов и тканей после завершения ими своих физиологических функций, например атрофия вилочковой железы после окончания формирования иммунной системы, атрофия половой системы женщин после завершения детородной функции, атрофия органов и тканей при старении человека и др.
Вместе стем апоптоз может развиваться и в условиях патологии — в тех случаях, когда повреждающие факторы действуют на гены, контролирующие включение программы апоптоза. Обычно это происходит с помощью определенных веществ — цитокинов, различных факторов роста, гормонов, активизирующихся при заболеваниях и функционирующих на молекулярном уровне. Эту особенность апоптоза нередко пытаются использовать в клинике. Например, в онкологии постоянно идет поиск возможностей стимулировать апоптоз в злокачественных опухолях с тем, чтобы активизировать распад опухолевых клеток, и это весьма перспективный путь онкотерапии.
Морфология апоптоза.
Апоптоз развивается в отдельных клетках, которые вначале теряют контакты с соседними клетками, затем уменьшаются в размерах, в их ядрах конденсируется хроматин. ядра становятся изрезанными, плотными и фрагментируются на отдельные глыбки. Одновременно происходит распад цитоплазмы, в которой сохраняются в конденсированной форме внутриклеточные структуры. В результате клетка распадается на апоптозные тельца, каждое из которых окружено мембраной. Апоптозные тельца очень быстро поглощаются окружающими клетками, иногда макрофагами. Однако в ответ на апоптоз никогда не развивается воспалительная реакция и на месте погибших клеток воспроизводятся клетки той же ткани. Следует подчеркнуть, что апоптозу подвергаются лишь клетки, но не ткани в целом.
НЕКРОЗ
Некроз — гибель клеток и тканей в результате патологических воздействий.
Причины некроза разнообразны, однако их можно объединить в пять групп:
- травматический некроз, который является результатом прямого действия на ткань физических или химических факторов (механических, температурных, радиационных, кислот, щелочей и др.);
- токсический некроз развивается при действии на ткани токсических факторов бактериальной или иной природы;
- трофоневротический некроз, который связан с нарушениями иннервации тканей при заболеваниях центральной или периферической нервной системы;
- аллергический некроз — следствие иммунных реакций немедленной или замедленной гиперчувствительности;
- сосудистый некроз, обусловленный прекращением циркуляции крови в артериях, реже — в венах.
По консистенции мертвых масс некроз может быть коагуляционным, казеозным и колликвационным.
Коагуляционный (плотный) некроз возникает при коагуляции распавшегося белка, обычно в мышечных тканях и в большинстве внутренних органов.
Разновидностью коагуляционного некроза является казеозный (творожистый) некроз, массы которого имеют замазкообразную консистенцию; развивается при некоторых видах воспаления.
Колликвационный некроз развивается в тканях, богатых жидкостью, например в головном мозге.
По механизму действия фактора, вызвавшего некроз, выделяют:
- прямой некроз, который возникает при непосредственном действии на ткань причины, вызывающей ее гибель, — травма, токсины, высокая или низкая температура и т. п.;
- непрямой некроз, когда причина гибели ткани связана с нарушениями функций сосудов, нервов или с аллергическими реакциями.
Некрозу предшествует период умирания, он никогда не возникает мгновенно. Период умирания может быть длительным или быстрым. В этот период в клетках и во внеклеточном матриксе развиваются изменения, представляющие собой тот или иной вид дистрофии, чаще белковый. Эти изменения называются некробиозом, или парабиозом. Функции клеток и органов при этом ослабевают и прекращаются, но на начальных этапах процесса они могут восстановиться, если ликвидирована причина, вызвавшая некробиоз. Если же причина продолжает действовать, дистрофия становится необратимой, некробиоз переходит в некроз и какие-либо функции прекращаются. Некротизированные ткани под действием гидролитических ферментов подвергаются разложению — аутолизу. В области очага некроза развивается воспаление как ответная реакция организма на гибель его части.
Морфология некроза зависит от его причины, но общим является изменение цвета некротизированной ткани и ее консистенции. Цвет некротических масс зависит от наличия примесей крови и различных пигментов. Мертвая ткань бывает белой или желтоватой, нередко окружена красно-бурым венчиком. При гнилостном расплавлении мертвая ткань издает характерный дурной запах. Микроскопические признаки некроза складываются из необратимых изменений ядер и цитоплазмы клеток. В период некробиоза клетки теряют воду, поэтому при некрозе ядра сморщиваются и уплотняются — развивается кариопикноз. Затем нуклеиновые кислоты в виде отдельных глыбок выходят из ядра в цитоплазму клетки — происходит распад ядра — кариорексис. Наконец, ядерное вещество растворяется — наступает кариолизис. Исчезновение клеточных ядер — один из основных признаков некроза. Та же динамика гибели наблюдается в цитоплазме, в которой развиваются плазморексис и плазмолиз. Наконец, растворяется вся клетка — происходит цитолиз.
При некрозе интерстициальной и сосудистой тканей экстрацеллюлярный матрикс набухает и расплавляется, волокнистые структуры подвергаются фибриноидному некрозу и уплотняются. Образовавшиеся некротические массы носят название некротический детрит. Вокруг очага некроза, отграничивая его от живых тканей, развивается демаркационная линия, представляющая собой зону воспаления. Эта линия имеет большое значение в хирургической практике, так как указывает на возможные пределы иссечения погибших тканей или уровень ампутации конечности.
Исходы некроза.
Благоприятный, при котором происходит ферментативное расплавление некротизированных тканей, после чего они подвергаются организации, т. е. замещению дефекта соединительной тканью, обычно с образованием рубца, или инкапсуляции, т. е. отграничению некротизированного участка соединительной тканью. При этом нередко некротизированные массы подвергаются петрификации. На месте колликвационного некроза образуется полость — киста.
Неблагоприятный, когда некроз ткани или органа заканчивается смертью больного, например инфаркт миокарда или некроз поджелудочной железы. Кроме того, некротизированные ткани могут подвергаться гнойному расплавлению, при котором токсичные продукты некроза и аутолиза всасываются в кровь, развивается интоксикация, которая также может привести к смерти.
Клинико-морфологические формы некроза.
В зависимости от локализации и особенностей некроза выделяют его следующие клинико-морфологические формы.
Гангрена — некроз тканей, соприкасающихся с внешней средой. При этом железо гемоглобина, находящегося в некротизированных тканях, соединяется с сероводородом воздуха и образуется сульфид железа, придающий некротизированным тканям черный цвет. Гангрена развивается в коже, конечностях, кишечнике, легких, влагалище, матке и т. д. Имеется несколько разновидностей гангрены (рис. 12):
- сухая гангрена развивается в тканях с малым содержанием жидкости, при этом ткани могут подвергаться мумификации. Она характерна для конечностей, возникает на разных участках тела при их отморожении, ожогах, при тяжелых инфекциях;
- влажная гангрена обычно развивается в тканях, богатых жидкостью, поэтому встречается в легких, матке, кишечнике. У ослабленных детей, страдающих корью или скарлатиной, иногда развивается влажная гангрена щеки — нома;
- анаэробная или газовая гангрена возникает при тяжелых, обычно массивных ранениях или травмах конечностей при попадании врану бактерий — анаэробов. Внекротизированных мышцах развивается коагуляционный некроз, они становятся грязно-серыми, при надавливании из них выделяются пузырьки газа.
Пролежень имеет трофоневротическое происхождение, возникает на участках кожи, подкожной клетчатки или слизистых оболочек. подвергающихся давлению у ослабленных больных, страдающих онкологическими, сердечно-сосудистыми и некоторыми инфекционными заболеваниями. Пролежни могут возникать вобласти крестца, ягодиц, пяточных костей, а также в трахее или гортани от давления трахеостомической трубки после операции трахеостомии.
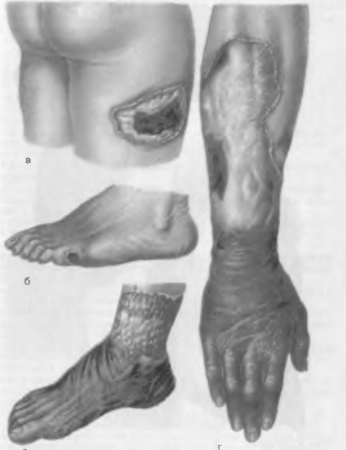
Рис. 12. Гангрена. Влажная гангрена кожи бедра (а) и стопы (б); сухая гангрена стопы (в), предплечья и кисти (г).
Секвестр — участок омертвевшей ткани, свободно располагающийся среди живых тканей, обычно сопровождающийся гнойным воспалением. Особенно часто секвестром является некротизированный фрагмент кости при остеомиелите.

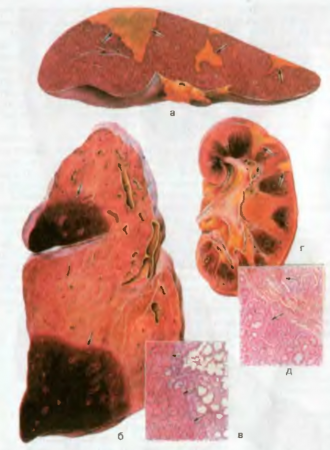
Рис. 13. Инфаркт. а — белые (ишемические) инфаркты селезенки; б — красные (геморрагические) инфаркты легкого; в — микроскопическая картина геморрагического инфаркта легкого; г — ишемические инфаркты почки; д — микроскопическая картина ишемического инфаркта почки. Участки некроза тканей показаны стрелками.
Инфаркт — некроз ткани внутренних органов, развивающийся в результате острого нарушения кровообращения в них при тромбозе, эмболии, длительном спазме артерий. Наиболее яркими примерами этого вида некроза являются инфаркты миокарда, головного мозга, легких, почек, селезенки (рис. 13). Инфаркты различают по форме и цвету, что зависит от особенностей органа и архитектоники его сосудистой системы:
- по форме
- — клиновидная;
- — неправильная.
- по цвету
- — белый;
- — красный;
- — белый с геморрагическим венчиком.
Сравнительная характеристика апоптоза и некроза
Отличия апоптоза от некроза связаны с различиями в их распространенности, генетических, биохимических, морфологических и клинических проявлениях:
- апоптоз — физиологический вид смерти, некроз возникает в условиях патологии;
- апоптоз генетически запрограммирован, некроз развивается под воздействием различных повреждающих причин и не связан с геномом клетки;
- апоптоз распространяется только на отдельные клетки, некроз развивается на территории ткани и даже целого органа;
- апоптоз не сопровождается дистрофическими изменениями клеток, некрозу предшествует дистрофия, имеющая характер некробиоза;
- апоптоз не сопровождается воспалением, вокруг некроза обязательно развивается воспалительная реакция;
- апоптоз заканчивается фагоцитозом апоптозных телец соседними клетками, некроз заканчивается аутолизом погибшей ткани;
- после апоптоза восстанавливаются клетки, аналогичные погибшим, на месте некроза обычно разрастается рубцовая соединительная ткань;
- апоптоз не сопровождается активацией внутриклеточных гидролитических ферментов, некроз развивается с помощью гидролаз;
- апоптоз не имеет клинических проявлений, некроз сопровождается выраженной клинической симптоматикой.
Апоптоз и некроз — два разных варианта гибели клеток и тканей в живом организме, хотя некоторые патогенные факторы, способные оказывать воздействие на генетический код, могут вызывать апоптоз. Однако при этом апоптоз все-таки остается физиологическим механизмом смерти, но активизирующимся в условиях определенной патологии.
Все описанные изменения — дистрофии, апоптоз и некроз — носят характер типовых (или стереотипных) реакций, которыми организм отвечает на различные воздействия, и те или иные их сочетания возникают при любых болезнях, что необходимо учитывать при назначении лечения.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Инфаркт миокарда — поражение сердечной мышцы с образованием участков некроза вследствие острой внезапной ишемии. Причиной недостатка кровоснабжения сердечной мышцы кровью в 90% становится атеросклероз сосудов. В зависимости от локализации некротического очага в миокарде и степени поражения сердечной мышцы различают инфаркт трансмуральный, обширный (инфаркт миокарда с зубцом q) и мелкоочаговый (инфаркт миокарда без зубца q). Инфаркт трансмуральный – наиболее тяжелая, сквозная форма поражения миокарда, характеризующаяся высоким риском летального исхода. Некротические изменения затрагивают и наружные слои сердечной мышцы: эпикард и эндокард.
Особенности классификации инфарктов по ЭКГ
Отличие обширного инфаркта от мелкоочагового инфаркта миокарда без зубца q заключается в разной степени поражения сердечной мышцы. Трансмуральный инфаркт обычно наступает при поражении крупных сосудов. При этом страдают глубокие участки мышцы. Снижение сократительной способности миокарда отражается на ЭКГ: возникает зубец Q.
При мелкоочаговом инфаркте кровоснабжение может частично восстановиться до момента, когда возникает обширный участок некроза, и многие кардиомиоциты (клетки сердечной мышцы) из зоны ишемии восстанавливаются. При этом мышца страдает значительно меньше, только эпикард или эндокард, и патологический зубец Q после начала болезни так и не возникает. Мелкоочаговые субэндокардиальные инфаркты наиболее распространены.
Важно! Хотя в первый период болезни мелкоочаговый не Q-инфаркт менее опасен, чем обширный Q-инфаркт, в перспективе частота рецидивов после микроинфаркта выше. Поскольку ишемия не проходит, и сосуд в зоне инфаркта остается поврежденным, для повторного инфаркта потребуется немного.
Процент смертности от q-образующего обширного инфаркта миокарда составляет 10-12% в госпитальный период.
Патология и симптомы острого трансмурального инфаркта миокарда
Клетки миокарда потребляют в три раза больше кислорода, чем остальные ткани организма. В условиях кислородного голодания клетки сердечной мышцы погибают быстро. Разные режимы функционирования организма сказываются на интенсивности сокращения миокарда и на объеме необходимого для их жизни кислорода. Поэтому нарушение притока крови через коронарные сосуды или недостаточность компенсаторного коллатерального кровообращения в стрессовых ситуациях приводит к гибели участков ткани миокарда.
Важно! Достаточно 20 минут для того, чтобы недостаточное кровоснабжение привело к необратимому некротическому поражению клеток сердечной мышцы.
Все причины патологии кровоснабжения миокарда делят на такие группы:
- Полное или частичное перекрывание просвета сосудов, приводящих кровь к сердцу, атеросклеротическими бляшками. Происходит постепенное нарастание тромба до достижения критически малого просвета либо отрыв бляшки от стенки сосуда с дальнейшим перекрыванием его просвета. К группе риска относятся больные сахарным диабетом, малокровием, ожирением, у которых склеивание тромбоцитов и оседание их на стенках сосудов происходит интенсивно.
- Внезапно наступившие условия, при которых возникла повышенная потребность сердечной мышцы в кислороде. Инфаркт трансмуральный может быть спровоцирован спазмом сосудов в результате эмоционального стресса, чрезмерной физической нагрузкой, другими заболеваниями, сопровождающимися высокой температурой, интоксикацией.
Трансмуральный инфаркт миокарда с зубцом q развивается стремительно, с ангинозными болевыми симптомами. Общим признаком, отличающим его от других типов заболевания, становится острая боль за грудиной, интенсивность которой может стать причиной болевого шока и вызвать смерть. Острейший период длится от нескольких часов до трех дней. Затем острая боль сменяется длительным болезненным ощущением в грудной клетке сдавливающего характера.
Болевые ощущения и стремительно развивающаяся сердечная недостаточность, нейтрофильный лейкоцитоз, повышение СОЭ внешне проявляются бледностью лица, выделением холодного липкого пота, коллапсом или потерей сознания. Типичное развитие симптоматики – появление на второй день температуры, устойчивое нарушение сердечного ритма, падение кровяного давления.
В зависимости от локализации пораженного участка симптоматика может отличаться от классических проявлений болезни. Часто инфаркт маскируется под другие болезни, что приводит к ложному диагнозу, и больной не принимает необходимых мер для предотвращения тяжелых последствий. Так, кроме типичной ангинозной картины, может наблюдаться другая симптоматика:
- Гастралгическая. Часто пациенты ощущают приступы боли, напоминающие проявления язвенной болезни, панкреатита. При этом боль возникает не за грудью, а в подложечной области, и болезненное состояние может сопровождаться рвотой.
- Астматическая. Приступы удушья сопровождаются отеком легкого. Болевые симптомы могут отсутствовать.
- Церебральная. Первые симптомы (обморок, рвота, судороги) похожи на ишемический инсульт.
- Безболевая. Тяжелый Q-инфаркт может протекать без острых болевых симптомов, если в коронарной системе длительно протекают дистрофические процессы. Чаще всего такие проявления имеет q-инфаркт задней стенки у пожилых людей, у больных, страдающих диабетом.
Важно! Дифференцировать инфаркт от стенокардии поможет отсутствие эффекта от приема нитроглицерина.
Из всех возможных локализаций самый распространенный тип инфаркта – поражение передней стенки в левом желудочке. Как правило, в процесс одновременно вовлекаются и другие участки сердца. Часто некроз миокарда левого желудочка сопровождается подобными же повреждениями в правом желудочке или в предсердии, врачи диагностируют нижнебоковые, передневерхушечные, заднебоковые и некрозы нижней стенки.
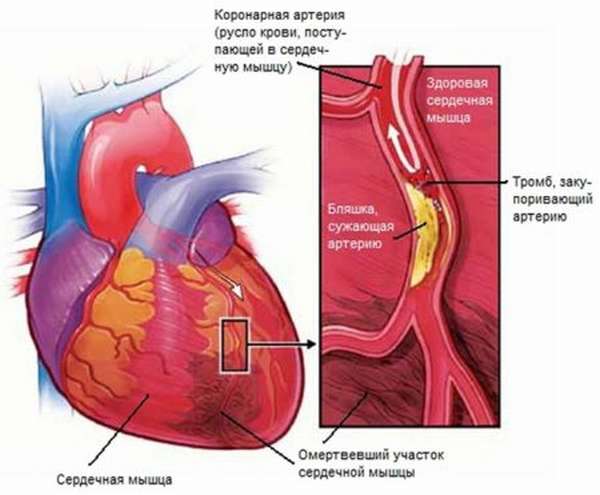
При трансмуральном поражении передней стенки левого желудочка заболевание несет прямую угрозу жизни, и прогнозы неутешительные. Возникают такие поражения при повреждениях магистральных сосудов. При этом больные могут погибнуть не только в период острой фазы болезни, но и в последующие месяцы.
Поражение задней стенки представляет опасность еще и тем, что зубец Q заднего инфаркта миокарда на ЭКГ не всегда появляется, и диагноз часто ставится после гибели пациента. Врач предварительно может определить локализацию пораженных участков по характерным болям под лопаткой, ключицей.
Важно! Часто бессимптомное протекание некротического поражения задней сердечной стенки проявляет себя повышенной тревожностью человека, субъективным ощущением опасности.
Как проявляется Q-инфаркт на ЭКГ
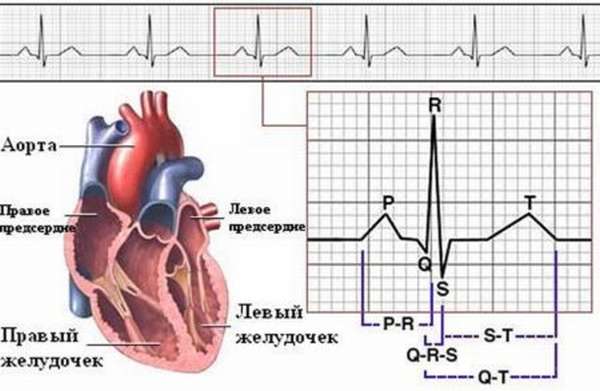
ЭКГ – главный метод, позволяющий точно диагностировать инфаркт миокарда с зубцом q, его давность, локализацию процесса и степень поражения сердечной мышцы. Наличие некроза фиксируется за счет изменения электрического потенциала разных зон сердечной мышцы.
При подозрении на инфаркт, ЭКГ необходимо выполнять через каждые полчаса. В первые часы на некроз миокарда может указывать только завышенный зубец T. В течение следующих двух часов наблюдают за сегментом ST. При его повышении на 1 мм в любых двух смежных отведениях диагноз подтверждается, назначается тромболитическая терапия. Инфаркт без зубца Q будет иметь именно эти признаки на ЭКГ: повышенный сегмент ST дугой вверх и острый зубец T (положительный или отрицательный).
Если больной страдает хроническими заболеваниями сердца (гипертрофия левого желудочка, перикардит), может возникнуть псевдоинфарктная кривая. В ней сегмент ST вогнутый, а в реципрокных отведениях он не занижен.
При подозрениях на инфаркт задней стенки используют задние отведения.
Обширный инфаркт проявится через 2-4 часа формированием на ЭКГ зубца Q.
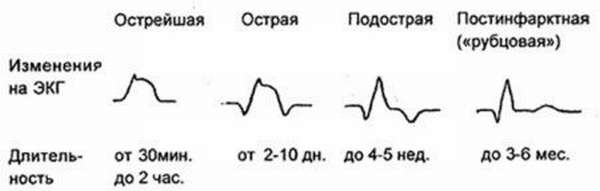
На основе изменений картины ЭКГ выделяют 4 этапа течения заболевания:
- Острейшая стадия. Характеризуется подъемом над изолинией участка ST, сливанием его с зубцом T и появлением в течение нескольких часов характерного зубца Q. По динамике появления этого зубца судят об обширности и степени патологии. На этом этапе после блокады болевого синдрома проводится терапия тромболизиса, об эффективности которой будут свидетельствовать ЭКГ признаки в виде снижения участка ST. Если этот сегмент остается завышенным после месяца терапии, это говорит о развитии в левом желудочке аневризмы. Именно длительное повышение сегмента ST – важный ЭКГ признак трансмурального некроза с неутешительным прогнозом.
- Острая стадия. На этом этапе при благоприятном течении отмечается снижение сегмента ST, возникает симметричный отрицательный коронарный зуб T, что вызывается уменьшением размеров поврежденного участка, отмиранием клеток, началом формирования ишемии прилегающих участков.
- Подострая стадия. Некротические повреждения стабилизируются, развивается стойкая ишемия. Завершается этап исчезновением пораженного участка. По динамике этого периода можно с высокой точностью классифицировать тип заболевания и прогнозировать успешность лечения и реабилитации.
- Стадия рубцевания. Патологический зубец Q сохраняется, но сегмент ST находится на изолинии. На этом этапе мышца зарубцовывается, оставшиеся клетки перестраиваются, гипертрофируются в компенсаторном режиме.
На ЭКГ остаются видны признаки перенесенного инфаркта, и в целом картина показывает сниженную электрофизическую динамику сердечной мышцы.
Двигательная адаптация после трансмурального инфаркта миокарда, ЛФК
Здоровый и подвижный образ жизни – один из главных способов предупредить инфаркт. Активация восстановительных процессов и нормализация кровообращения в госпитальный и послебольничный период во многом зависит от регулярных и дозированных физических нагрузок. Лечебная физкультура рассматривается как равноправный терапевтический метод реабилитации больных наравне с медикаментозным лечением.
Умеренная двигательная активность позволяет быстрее запустить коллатеральное компенсаторное кровообращение, что ускорит восстановление миокарда.
На практике существует поэтапная система реинтеграции больного в активные жизненные процессы:
- ЛФК в стационаре. После периода полного покоя больной заново адаптируется к привычным бытовым нагрузкам. Основным упражнением для восстановления двигательной активности становится ходьба, лечебная гимнастика.
- Реабилитация в послебольничный период проходит в условиях специализированных санаториев и реабилитационных центров. На этом этапе главной целью является активация резервных возможностей организма, пациент занимается на тренажерах, принимает участие в двигательных спортивных играх.
- Поддерживающая ЛФК. Эти мероприятия становятся образом жизни человека, что помогает ему оставаться в хорошей физической форме.
Обширный инфаркт миокарда: прогноз
О прогнозе течения болезни врач судит по динамике острого периода. Это заболевание тяжелое и опасное, и о полном выздоровлении речь не идет. Смертельный исход возможен от многих причин: кардиогенный шок, разрыв миокарда, тромбоэмболия, аневризма, сердечная недостаточность, аритмия.
После перенесенного не q-инфаркта миокарда интенсивность наблюдения у врача должна быть не менее высокой, так как велик риск рецидива в более опасной форме. Такие больные обречены на пожизненный прием препаратов, разжижающих кровь (аспирин), им необходимо внимательно следить за уровнем холестерина. При показаниях проводится операция по шунтированию проблемной аорты.
После такого испытания, как инфаркт миокарда, нужно быть готовым к тому, что придется полностью изменить образ жизни, питания, отказаться от вредных привычек, постоянно принимать лекарства, предотвращающие повторное образование тромбов и нормализующие сердечный ритм. При этом остается высокий риск повторного инфаркта, поэтому придется постоянно проводить обследование ЭКГ.
Загрузка…
Источник
