Хроническая сердечная недостаточность при хронической болезни почек

Н.А. Мухин, В.С. Моисеев, Ж.Д. Кобалава
ГОУ ВПО “Российский университет дружбы народов”, Москва
МКБ-10:
XIV.N17-N19.N18
Хроническая почечная недостаточность
Сердечно-сосудистые заболевания (ССЗ) – самая частая причина смерти при хронической болезни почек (ХБП), которая является независимым фактором риска (ФР) развития ССЗ и смерти.
сердечно-сосудистые заболевания, хроническая болезнь почек, кардиоренальный синдром, ренин-ангиотензин-альдостероновая система
Кардиология : Национальное руководство / Под ред. Е. В. Шляхто. – 2-е изд., перераб. и доп. – М.: ГЭОТАР-Медиа, 2015. – C. 691 -694.
Кардиология: новости, мнения, обучение. 2015. № 2. С. 63-66.
Кардиоренальный синдром
Заболевания сердца и почек имеют общие традиционные ФР [артериальная гипертензия (АГ), сахарный диабет (СД), ожирение, дислипидемия и др.], а при их сочетании действуют и нетрадиционные почечные факторы (гипергидратация, анемия, нарушения фосфорно-кальциевого обмена, системное воспаление, гиперкоагуляция), которые также могут оказывать влияние на риск развития и патогенез ССЗ.
По данным многочисленных проспективных исследований, даже незначительное снижение функции почек ассоциировано с увеличением риска сердечно-сосудистой заболеваемости и смерти.
В свою очередь, вероятность развития нарушения функции почек у больных с ССЗ значительно выше, чем в популяции. По данным регистра NHANES III (Third National Health and Nutrition Examination Survey), сочетание любых двух факторов ССР приводит к вероятности снижения СКФ <60 мл/мин в 3,7 раза больше, чем при сохранной функции почек. Даже у пациентов с АД в пределах 130-139/85-89 мм рт.ст. вероятность появления микроальбуминурии увеличивается в 2,13 раза по сравнению с таковой при нормальных значениях АД.
В 1990 г. A. Guyton представил кардиоренальные взаимосвязи в виде гемодинамической модели кардиоренального синдрома (КРС). Центральные звенья этой модели – ренин-ангиотензин-альдостероновая система (РААС), эндотелийзависимые факторы, их антагонисты – натрийуретические пептиды (НУП) и калликреинкининовая система. При поражении одного из органов вследствие активации РААС и симпатической нервной системы, развития дисфункции эндотелия и хронического системного воспаления образуется порочный круг – патофизиологическое состояние, при котором сочетание кардиальной и почечной дисфункции приводит к ускоренному снижению функциональной способности каждого органа.
Термин “кардиоренальный синдром” долгое время использовали для обозначения нарушения функций неизмененной почки в условиях кардиальной дисфункции.
Современная концепция КРС охватывает весь спектр кардиоренальных взаимоотношений и на основании особенностей патофизиологического процесса, временны’х факторов и причин дисфункции почек или сердца описывает 5 типов этого синдрома.
На согласительной конференции ADQI в Венеции (2008) C. Ronco и соавт. представили классификацию КРС с выделением 5 типов. Кардиоренальный синдром – это патофизиологическое расстройство сердца и почек, при котором острая или хроническая дисфункция одного из этих органов ведет к острой либо хронической дисфункции другого. Таким образом, КРС включает различные острые и хронические расстройства, при которых первично пораженным органом может быть как сердце, так и почка.
Острый кардиоренальный синдром (КРС I типа) Характеризуется внезапным ухудшением сердечной деятельности, приводящим к острому почечному повреждению (ОПП); встречается при ОКС в 9-19%, при кардиогенном шоке – в 70% случаев. Острая декомпенсация ХСН осложняется ОПП у 24-45% больных. ОПП обычно развивается в первые дни госпитализации: в 50% – в первые 4 дня, 70-90% – в первые 7 дней. У этих пациентов часто в анамнезе имеются хронические нарушения функций почек, предрасполагающие к развитию ОПП. Развитие ОПП ассоциируется с повышением риска сердечно-сосудистой и общей смертности, более продолжительной госпитализацией и частотой повторных госпитализаций, прогрессированием ХБП (при ее наличии) до IV-V стадий при остром коронарном синдроме (ОКС), инфаркте миокарда (ИМ), чрескожных коронарных вмешательствах (ЧКВ) и аортокоронарном шунтировании (АКШ).
Риск неблагоприятных исходов увеличивается независимо от транзиторности или устойчивости ОПП; более тяжелое ОПП ассоциируется с более высоким риском смерти.
Развитие ОПП при остром КРС обусловлено нарушением перфузии почек вследствие снижения сердечного выброса (СВ) и/или значительного повышения венозного давления. Часто развивается резистентность к диуретической терапии. Наличие ОПП с/без гиперкалиемии ограничивает применение иАПФ, БРА и антагонистов альдостерона у пациентов с сердечной недостаточностью (СН), ИМ, что может отрицательно влиять на исходы заболевания.
Хронический кардиоренальный синдром (КРС II типа) Характеризуется наличием хронической патологии сердца [например, хронической сердечной недостаточности (ХСН)], приводящей к прогрессированию ХБП.
Нарушение функционального состояния почек широко распространено среди пациентов с ХСН (45-63,6%) и является независимым негативным прогностическим фактором в отношении развития систолической и диастолической дисфункции левого желудочка (ЛЖ), сердечно-сосудистой смерти, при этом выявлен биологический градиент между выраженностью почечной дисфункции и ухудшением клинических исходов.
Один из основных факторов повреждения при хроническом КРС – длительно существующая гипоперфузия почек, которой предшествуют микро- и макроангиопатии.
Функциональное состояние почек также может ухудшаться вследствие терапии ХСН.
Острый кардиоренальный синдром (КРС III типа) Характеризуется первичным внезапным нарушением функции почек (например, при остром гломерулонефрите или пиелонефрите, остром канальцевом некрозе, острой обструкции мочевыводящих путей), которое приводит к острому нарушению функции сердца (СН, аритмиям, ишемии). Распространенность ОПП при коронарной ангиографии (КАГ) и кардиохирургических вмешательствах составляет 0,3-29,7% и ассоциируется с высокой смертностью.
ОПП влияет на функциональное состояние сердца посредством нескольких механизмов, иерархия которых не установлена. Перегрузка жидкостью может привести к развитию отека легких, гиперкалиемия способствует возникновению аритмий и остановки сердца, а накопление уремических токсинов снижает сократительную способность миокарда и приводит к развитию перикардита.
Кроме того, ишемия почек может сама по себе провоцировать воспаление и апоптоз кардиомиоцитов.
Особая форма КРС III типа – стеноз почечных артерий. В патогенезе развития острой СН или острой декомпенсации ХСН в таких случаях играют роль диастолическая дисфункция левого желудочка (ДД ЛЖ), связанная с длительным повышением артериального давления (АД) из-за чрезмерной активации РААС, задержка натрия и воды на фоне нарушения функций почек и острая ишемия миокарда, обусловленная повышенной его потребностью в кислороде на фоне периферической вазоконстрикции.
При тяжелом ОПП, требующем заместительной почечной терапии, могут развиться гипотензия, нарушения ритма и проводимости, миокардиальная ишемия, обусловленная быстрым перемещением жидкости и электролитов при диализе.
Хронический кардиоренальный синдром (КРС IV типа) Основные причины поражения почек в последние годы – сахарный диабет типа 2 и АГ; заметную роль играют атеросклероз, ХСН и ожирение. Возрастает интерес к патогенетической роли относительного или абсолютного дефицита эритропоэтина при ХБП, который может стать причиной активации процессов апоптоза, фиброза и воспаления в миокарде, а также развития анемии.
Вторичный кардиоренальный синдром (КРС V типа) Характеризуется наличием сочетанной почечной и кардиальной патологии вследствие острых или хронических системных расстройств, при этом нарушение функции одного органа влияет на функциональное состояние другого, и наоборот. Примеры таких заболеваний – сепсис, диабет, амилоидоз, системная красная волчанка, саркоидоз, системные васкулиты. Сепсис – наиболее частое и тяжелое состояние, влияющее на функцию сердца и почек.
Диагностика кардиоренальных синдромов
Лабораторная диагностика
Выявление острого повреждения миокарда при КРС I и III типов обычно не вызывает затруднений. В настоящее время натрийуретические пептиды (BNP, NT-proBNP) – признанные маркеры острой СН и острой декомпенсации ХСН.
Тропонины используют в качестве чувствительных маркеров некроза миокарда. Однако повышение уровней тропонинов наблюдается и у пациентов с ХБП без клинической картины ОКС, а также имеет прогностическое значение при КРС IV типа.
Цистатин С превосходит креатинин в диагностике нарушений функции почек и коррелирует с длительностью и тяжестью ОПП. Повышение уровня цистатина С в сыворотке крови – маркер снижения скорости клубочковой фильтрации (СКФ), а в моче он указывает на канальцевую дисфункцию.
Наиболее ранние маркеры, выявляемые в крови и моче пациентов с ОПП, – NGAL (липокалин, ассоциированный с нейтрофильной желатиназой), KIM-1 (молекула почечного посреждения 1), ИЛ-18 (интерлейкин-18) и NAG (лизосомальный фермент N-ацетил-β-d-глюкозаминидазы), появление которых опережает повышение уровня креатинина у таких больных на 48-72 ч.
Ранние маркеры хронического КРС (II типа) – появление и персистирование ФР развития и прогрессирования хронической сердечной и почечной дисфункции (альбуминурия, снижение ФВ ЛЖ и СКФ, ГЛЖ). ССО у больных с ХБП (КРС IV типа) ассоциируются с повышением плазменных уровней таких специфических биомаркеров, как тропонины, ADMA (асимметричный диметиларгинин), PAI 1 (ингибитор активатора плазминогена I типа), гомоцистеина, НУП, C-реактивного белка, сывороточного амилоидного белка А, альбумина, модифицированного ишемией.
Визуализирующие методы диагностики
В настоящее время наиболее перспективные неинвазивные методы – мультифотонная микроскопия почек, а также фазовоконтрастная магнитно-резонансная томография (МРТ), позволяющая оценить кровоток в сосудах почек. Перспективным представляется использование метода биоимпедансного векторного анализа в сочетании с определением некоторых биомаркеров.
Острое почечное повреждение
До недавнего времени ОПП обозначалось термином “острая почечная недостаточность” (ОПН). Термин “острое почечное повреждение” включает весь спектр синдрома ОПН – от незначительных изменений функционального состояния почек до состояний, требующих проведения заместительной почечной терапии.
В 2012 г. опубликованы первые рекомендации KDIGO (Kidney Disease Improving Global Outcomes) по диагностике и лечению ОПП. Диагностические критерии ОПП (табл. 1):
– повышение сывороточного креатинина хотя бы до >0,3 мл/дл (26,5 мкмоль/л) в течение 48 ч или в 1,5 раза в течение предшествующих 7 дней;
– снижение диуреза менее 0,5 мл/кг/ч за 6 ч. Стадию ОПП определяют на основании уровня креатинина и диуреза.
Риск развития ОПП повышается как в присутствии ФР ОПП (критическое состояние больного, сепсис, шок, травмы и ожоги, кардиохирургические и большие хирургические вмешательства, нефротоксичные и рентгенконтрастные препараты, отравления), так и при наличии состояний, повышающих восприимчивость пациента к ФР ОПП (дегидратация, пожилой возраст, женский пол, негроидная раса, острые и хронические заболевания, СД, рак, анемия, проводимая терапия).
Ведение больных осуществляют в соответствии со стадией повреждения и его этиологией под контролем уровня креатинина и диуреза. Пациентов с ОПП наблюдают в течение 3 мес.
Хроническая болезнь почек
В 2012 г. предложена модификация классификации хронической болезни почек (ХБП). ХПБ определяют как изменение структуры или функции почек, которое сохраняется более 3 мес и влияет на состояние здоровья человека.
В случае сохранной или повышенной СКФ, а также у больных с ее начальным снижением (60<СКФ <90 мл/мин/1,73 м2) для диагноза ХБП необходимо наличие признаков повреждения почек:
– альбуминурия >30 мг/сут или отношение альбумин/креатинин в моче >30 мг/г (>3 мг/ммоль);
– изменение осадка мочи;
– электролитные нарушения;
– структурные и морфологические изменения;
– трансплантация почки в анамнезе.
При СКФ <60 мл/мин/1,73 м2 ХБП диагностируют даже при отсутствии маркеров повреждения почек.
Новые рекомендации предлагают классифицировать ХБП с учетом категорий СКФ (табл. 2) и альбуминурии (табл. 3), что позволяет стратифицировать больных с ХБП по риску развития осложнений.
Для оценки функционального состояния почек, кроме особых ситуаций, для расчета СКФ рекомендуют использовать формулу CKD-EPI (2009), а для оценки альбуминурии предпочтительнее рассчитывать отношение альбумин/креатинин или протеин/креатинин в утренней порции мочи.
При ХБП риск осложнений обратно пропорционален СКФ, поэтому пациенты нуждаются в регулярном контроле СКФ и альбуминурии для оценки прогрессирования.
Хроническая болезнь почек в современных рекомендациях ХБП рассматривается как независимый ФР развития ССЗ и как эквивалент ишемической болезни сердца (ИБС) по риску осложнений. В соответствии с национальными рекомендациями по кардиоваскулярной профилактике (2011), а также диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза (2012), пациентов с ХБП (определяемой по СКФ <60 мл/мин/1,73 м2) относят к категории очень высокого риска развития смертельных ССО, что предполагает соответствующую тактику достижения целевых уровней ХС-ЛПНП <1,8 ммоль/л для данной категории риска. Европейские рекомендации по сердечно-сосудистой профилактике (2012) предлагают разделять больных с ХБП на категории высокого (СКФ 30-60 мл/мин/1,73 м2) и очень высокого (СКФ <30 мл/мин/1,73 м2) риска смертельных ССО.
Существенно изменен почечный раздел европейских рекомендаций по АГ (2013). Так, при стратификации больных по риску ССО в рубриках “Поражение органовмишеней” и “Ассоциированные клинические состояния” исключены диагностические критерии по креатинину сыворотки, а критерии по расчетной СКФ заменены на категорию ХБП. При этом ХБП разделена по рубрикам в зависимости от уровня СКФ: пациентов с ХБП и СКФ 30-60 мл/мин/1,73 м2 (ХБП III стадии) относят к имеющим поражение органов-мишеней, а пациентов с ХБП и СКФ <30 мл/мин/1,73 м2 (ХБП IV-V стадий) – к имеющим ассоциированные клинические состояния.
В Международных рекомендациях 2012-2013 гг. сформулированы новые целевые уровни АД у больных с ХБП.
С позиций доказательной медицины у пациентов с диабетической и недиабетической нефропатией уровень целевого систолического АД составляет <140 мм рт.ст., а при наличии явной протеинурии можно рассматривать достижение целевого уровня АД < 130 мм рт.ст. при условии мониторирования динамики СКФ. Целевой уровень диастолического АД составляет <90 мм рт.ст.
Снижение протеинурии признают терапевтической целью. Убедительно показано, что блокаторы РААС более эффективны в снижении альбуминурии у больных с диабетической и недиабетической нефропатией, ССЗ, а также эффективны в предотвращении микроальбуминурии.
Дозирование препаратов осуществляют с учетом СКФ.
В то же время рекомендуют временную отмену потенциально нефротоксичных препаратов у пациентов с СКФ <60 мл/мин/1,73 м2 (стадии IIIа-V) при тяжелых интеркуррентных заболеваниях, прежде всего это относится к блокаторам РААС, диуретикам, НПВП, метформину, препаратам лития и дигоксину.
Сведения об авторе
Жанна Давидовна Кобалава – доктор медицинских наук, профессор, заведующая кафедрой пропедевтики внутренних болезней медицинского факультета, кафедрой кардиологии и клинической фармакологии факультета повышения квалификации медицинских работников, Президент Общероссийской ОО “Содействия профилактике и лечению артериальной гипертензии “Антигипертензивная лига”, место работы: ГОУ ВПО “Российский университет дружбы народов”, Москва
e-mail: zkobalava@mail.ru
XIV.N17-N19.N18
Хроническая почечная недостаточность
Литература
1. Функциональное состояние почек и прогнозирование сердечно-сосудистого риска. Рекомендации ВНОК и НОНР // Кардиоваскуляр. тер. и профилактика. 2008. Т. 7, № 6. Прил. 3.
2. Мухин Н.А., Моисеев В.С., Кобалава Ж.Д. Кардиоренальные взаимодействия: клиническое значение и роль в патогенезе заболеваний сердечно-сосудистой системы и почек // Тер. арх. 2004. Т. 6. С. 39-46.
3. Roger V.L., Go A.S., Lloyd-Jones D.M. et al. Heart Disease and Stroke Statistics 2012 Update: A Report from the American Heart Association // Circulation. 2012. Vol. 125. P. e2-e220.
4. Culleton B.F., Larson M.G., Wilson P.W. et al. Cardiovascular disease and mortality in a community-based cohort with mild renal insufficiency // Kidney Int. 1999. Vol. 56. P. 2214-2219.
5. Go A.S., Chertow G.M., Fan D. et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization (see comment) // N. Engl. J. Med. 2004. Vol. 351. P. 1296-1305.
6. Bongartz L.G., Cramer M.J., Doevendans P.A. et al. The severe cardiorenal syndrome: “Guyton revisited” // Eur. Heart J. 2005. Vol. 26. P. 11-17.
7. Ronco C., McCullough P., Anker S. et al. Cardio-renal syndromes: report from the consensus conference of the Acute Dialysis Quality Initiative // Eur. Heart J. 2010. Vol. 31. P. 703-711.
8. KDIGO Clinical Practice Guideline for Acute Kidney Injury // Kidney Int. 2012. Vol. 2 P. 1-138.
9. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease // Kidney Int. 2013. Vol. 3. P. 1-150.
10. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease // Kidney Int. 2012. Vol. 2, N 5. P. 1-85.
Источник
Вероятность развития почечной дисфункции у больных с сердечно-сосудистой патологией значительно выше, чем в популяции, а функциональное состояние почек является независимым негативным прогностическим фактором в отношении развития систолической и диастолической дисфункции левого желудочка, а также сердечно-сосудистой смерти.
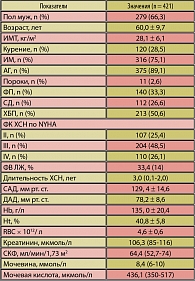
Таблица 1. Клинико-демографическая характеристика больных

Таблица 2. Клинико-демографическая характеристика пациентов с ХСН в зависимости от уровня СКФ (n = 421)

Таблица 3. Частота выявления анемии в зависимости от уровня СКФ

Таблица 4. Распределение ФК ХСН в зависимости от уровня СКФ

Таблица 5. Лабораторные показатели в зависимости от СКФ (n = 421)
Высокая значимость этих ассоциаций подтверждается созданием национальным Институтом сердца, легких и крови (США) рабочей группы (Working Group on Cardio-Renal Connections in Heart Failure by the National Heart, Lung and Blood) по кардиоренальным взаимодействиям при сердечной недостаточности в августе 2004 года (1, 2).
По данным de Silva, только у 7% из 1216 больных со стабильной хронической сердечной недостаточностью (ХСН) расчетная скорость клубочковой фильтрации (СКФ) была в пределах нормальных значений, а у большинства пациентов (83%) была диагностирована 2 или 3 стадия хронической болезни почек (ХБП) (3).
Ранее считалось, что ведущим этиологическим фактором развития почечной дисфункции при ХСН является гипоперфузия почечной паренхимы, однако исследование ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary Catheterization Effectiveness) не выявило связи между показателями центральной гемодинамики и уровнем сывороточного креатинина (4). Для состояния сердечной недостаточности характерны также нейрогормональные нарушения в виде повышения продукции вазоконстрикторов (адреналина, ангиотензина, эндотелина) и изменения чувствительности и/или высвобождения эндогенных вазодилататоров (натрийуретических пептидов, оксида азота). При этом несмотря на снижение почечного кровотока, повышается почечное перфузионное давление, повреждается базальная мембрана клубочка и развивается микроальбуминурия (МАУ), протеинурия и нефросклероз. Кроме того, функциональное состояние почек также может ухудшаться вследствие таких сопутствующих заболеваний, как артериальная гипертония (АГ) и сахарный диабет (СД) 2 типа, а также терапии ХСН – предполагается роль гиповолемии, связанной с увеличением диуреза, ранней блокады РААС, гипотонии, связанной с приемом препаратов (5-7).
По современным представлениям, сочетание хронической сердечной патологии (ХСН) и длительно существующего снижения функциональной способности почек и/или имеющихся признаков повреждения почек (ХБП) соответствует второму типу кардиоренального синдрома (КРС) и приводит к ускоренному снижению функциональной способности каждого из органов, ремоделированию миокарда, сосудистой стенки и почечной ткани, росту заболеваемости и смертности (8, 9).
В последнее время возрастает интерес к патогенетической роли относительного или абсолютного дефицита эритропоэтина, который приводит к развитию анемии у пациентов с ХСН и ХБП, при этом выраженность ее нельзя объяснить только снижением функции почек (10). По данным некоторых клинических исследований, назначение эритропоэз-стимулирующих препаратов пациентам с ХСН, ХБП и анемией приводит к улучшению качества жизни, функционального состояния сердца, уменьшению размеров ЛЖ и снижению уровня мозгового натрийуретического пептида. В то же время возможность применения их в этой популяции больных вызывает большие сомнения, поскольку связано с увеличением риска сердечно-сосудистых осложнений (11-15).
Учитывая, что до недавнего времени пациенты с ХСН и выраженным нарушением функции почек практически не включались в крупные рандомизированные исследования, а также рост этой популяции больных, необходимо проведение контролируемых научных исследований, которые позволят улучшить прогноз, снизить заболеваемость и смертность для такой часто встречающейся и тяжелой сочетанной патологии.
Материал и методы
На базе терапевтических и кардиологических отделений ГКБ №64 г. Москвы был проведен ретроспективный анализ историй болезни 421 пациента с ХСН II-IV ФК и систолической дисфункцией в стадии компенсации, средний возраст которых составил 60,0 ± 9,7 года (таблица 1). Женщин было 142 (43,7%), мужчин – 279 (66,3%). Средняя длительность течения ХСН составила 3,0 (0,1-2,0) года. Наиболее частыми причинами развития ХСН были перенесенный инфаркт миокарда (75,1%) и ГБ (89,1%). У половины больных имелась ХБП (50,6%), которая диагностировалась по критериям K/DOQI. Более 26% страдали СД 2 типа, нарушение ритма сердца по типу фибрилляции предсердий имели 33,3% пациентов. Чаще всего встречался III ФК ХСН (48,5%), реже – II ФК (25,4%) и IV ФК – у 26,1% больных. Все пациенты получали стандартную терапию ХСН: ингибиторы ангиотензин-превращающего фермента (АПФ) 370 (87,9%), блокаторы рецепторов ангиотензина II (БРА) 18 (4,3%) пациентов, b-блокаторы – 363 (86,2%), a-, b-блокаторы – 58 (13,8%), тиазидовые диуретики – 212 (50,4%), антагонисты альдостерона – 226 (53,7%).
Всем пациентам выполнялось стандартное клинико-лабораторное обследование, СКФ рассчитывали по формуле МDRD, которая в среднем по группе составила 64,4 (52,7-74) мл/мин/1,73 м2.
Результаты обработаны статистически с использованием критерия t Стьюдента, проводился однофакторный корреляционный анализ. Использовали компьютерную программу Statistica for Windows 6,0. Показатели представлены как М ± SЕ. Различия достоверны при р
Результаты и обсуждение
Средний уровень СКФ у пациентов с ХСН составил 64,4 (52,7-74,0) мл/мин/1,73 м2. Стойкое снижение СКФ менее 60 мл/мин/1,73 м2 (III стадия ХБП) зафиксировано у 41% (174) пациентов.
Для оценки изучаемых показателей в зависимости от уровня СКФ больные делились на две группы: I группа – уровень СКФ 2 (n = 183), II группа – СКФ > 60 мл/мин/1,73 м2 (n = 228). Клинико-демографическая характеристика пациентов в зависимости от уровня СКФ представлена в таблице 2.
Группы были сопоставимы по частоте ИМ в анамнезе и частоте выявления ФП. В группе пациентов со СКФ ниже 60 мл/мин/1,73 м2 преобладали больные более старшего возраста, чаще встречались АГ и СД, преимущественно у женщин, в этой же группе достоверно чаще выявлялась анемия.
Показатели СКФ обратно коррелировали с частотой выявления анемии (R = -0,2; р = 0,04), прямо коррелировали со значениями гемоглобина (R = 0,4; р
При проведении множественного регрессионного анализа было выявлено, что частота выявления анемии зависит от уровня СКФ (beta = 0,178, р
Таким образом, при снижении СКФ частота анемии увеличивалась, достигая 65% при СКФ 2 (таблица 3).
Достоверно различались группы по II и IV ФК ХСН по NYHA, как видно из таблицы 4. При СКФ менее 60 мл/мин/1,73 м2 чаще встречался IV ФК ХСН (р = 0,01), отмечалась тенденция к увеличению частоты III ФК ХСН (р = 0,06).
Таким образом, при повышении ФК по NYHA достоверно снижалась СКФ. Однако показатели СКФ не зависели от длительности ХСН (р = 0,4) и ФВ ЛЖ (р = 0,1). Это может быть обусловлено тем, что мы исследовали пациентов с ФВ ЛЖ менее 45% и средней СКФ 64,4 (52,7-74,0) мл/мин/1,73 м2, т.е. группы были достаточно однородны.
В группе со СКФ 2 значения гемоглобина (р
Средние значения мочевины и мочевой кислоты были достоверно выше у больных с более выраженным снижением СКФ (р
При анализе показателей воспалительного профиля в группе СКФ 2 отмечались более высокие показатели СРБ (р = 0,01).
Таким образом, у пациентов со СКФ ниже 60 мл/мин/1,73 м2 чаще выявлялась анемия, а уровни гемоглобина, гематокрита и количество эритроцитов были достоверно ниже, чем в группе со СКФ выше 60 мл/мин/1,73 м2. Для группы со сниженной функциональной способностью почек был характерен более тяжелый ФК ХСН и достоверно более высокие значения СРБ.
Выводы
- В обследованной группе больных с систолической стабильной ХСН (II-IV ФК по NYHA) стойкое снижение СКФ менее 60 мл/мин/1,73 м2, соответствующее третьей стадии ХБП, зафиксировано у 41% (174) пациентов.
- В группе пациентов со СКФ ниже 60 мл/мин/1,73 м2 преобладали больные более старшего возраста и женщины с наличием АГ и СД. У этих больных достоверно чаще выявлялась анемия.
- При снижении СКФ достоверно увеличивался ФК по NYHA, однако связи между величиной СКФ и ФВ ЛЖ выявить не удалось.
- Пациенты со СКФ ниже 60 мл/мин/1,73 м2 отличались более низким уровнем гемоглобина, гематокрита, эритроцитов, более высокими значениями СРБ.
Источник
