Гистологическая картина инфаркта миокарда
Макроскопические изменения миокарда при острой
коронарной недостаточности, обусловившей смерть в течение нескольких минут и
десятков минут либо вовсе незаметны, либо обнаруживаются дряб-лость.
неравномерное кровенаполнение некоторых участков миокарда. Через 3-6 часов очаг
инфаркта миокарда еще нечетко очерчен, нерав-номерно окрашен из-за чередования
ишемизированных и полнокровных участков. Через 12 часов границы очага
становятся четче, он при-обретает серовато-красный цвет. Через 1 сутки участок
становится желтовато-серым, вокруг него определяется зона гиперемии. Через 3-6
дней участок приобретает желтый цвет с зеленоватым оттенком. Через 7-15 дней он
становится желто-зеленым с сероватым оттенком по периферии. Через 15-30 дней
очаг приобретает серовато-белесоватый оттенок, становясь белесоватым плотным
рубцом.
Инфаркт
миокарда, развивающийся в течение первых 3 недель считают острым. Рубцующийся
(организующийся острый) инфаркт миокарда развивается на протяжении 3-8 недель.
При сочетании орга-низующегося инфаркта миокарда с острым процесс носит название
рецидивирующего инфаркта миокарда. Сочетание Рубцовых измене-ний с острым
инфарктом миокарда (возникает после 8 недель репара-ции) получило название
повторного инфаркта миокарда.
Микроскопически
через несколько десятков минут после смерти от острой коронарной
недостаточности в миокарде можно найти субсегментарные контрактуры миофибрилл.
Через 3-6 часов обнаружива-ется пикноз ядер, глыбчатый распад миофибрилл,
исчезновение гли-когена из кардиомиоцитов, неравномерное расширение, извитость
капилляров, полнокровие, стаз. В стенках некоторых сосудов плазма-тическое
пропитывание интимы, пикноз эндотелия, имеется краевое стояние и эмиграция
лейкоцитов. Наблюдается отек стромы.
Через
6-12 часов увеличивается число кардиомиоцитов с комко-ватой и эозинофильной
цитоплазмой, нарастает количество нейтрофи-лов, появляются немногочисленные
макрофаги.
Через
24 – 48 часов значительно увеличивается количество ней-трофилов и макрофагов,
усиливается их распад, из-за чего появляется базофилия межуточной ткани. Появляются
клетки типа лимфоцитов.
Через
3-6 дней в очаге поражения миокарда и вокруг него разви-ваются капилляры, пролиферируют
фибробласты, появляются колла-геновые волокна.
Через
7-14 дней вокруг зоны некроза развивается неспецифиче-ская грануляционная
ткань.
КЗ-4
неделе мелкие и к 4 – 8 неделе крупные очаги поражения миокарда замещаются
рубцовой тканью.
Сводные
данные представлены в таблице.
Динамика микроскопических изменений при инфаркте миокарда
Гистологические элементы | 3-5 час | 6-12 час | 24 час | 2 сут. | 3-6 сут. | 7-10 сут. | 2 вед. | Знед. | 6 нед. | >6 нед. |
Пикноз ядер | ++++ | ++++ | +++ | +++ | ++ | + | + | |||
Некроз миоцитов | + | + | ++ | ++++ | +++ | ++ | + | |||
Отек стромы | ++ | +++ | ++++ | ++++ | +++ | + | ||||
Нейтрофилы | + | + | ++ | ++++ | ++++ | +++ | ++ | + | + | + |
Эозинофилы | + | ++ | + | + | ||||||
Макрофаги | + | ++ | ++ | +++ | +++ | ++++ | ++++ | ++++ | ++ | |
Лимфоциты | + | ++ | ++ | +++ | +++ | ++++ | ++++ | ++++ | ++ | |
Плазмоциты | + | ++ | +++ | 1111 | ++++ | + | ||||
Фибробласты | + | +++ | ++++ | +++ | +++ | +++ | ||||
Коллаген | + | ++ | ++++ | ++++ | +++ | ++ | ||||
Капилляры | + | ++ | +++ | ++ | + |
похожие статьи
Ложная посттравматическая аневризма бедра как причина смерти / Федченко Т.М., Дмитриева О.А., Боканович И.Б., Дмитриев М.О. // Медицинская экспертиза и право. — 2010. — №6. — С. 46-48.
Скоропостижная смерть при имплантированном искусственном водителе ритма сердца / Лукаш А.А. // Судебно-медицинская экспертиза. — М., 1968. — №4. — С. 37-39.
Идентификация причин внезапной сердечной смерти при посредстве гистохимических методов исследования / Швалев В.Н., Гуски Г., Сосунов А.А. // Матер. IV Всеросс. съезда судебных медиков: тезисы докладов. — Владимир, 1996. — №2. — С. 29-31.
К вопросу о саморазрывах сердца / Кечек К.С. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 109-111.
О самопроизвольных разрывах сердца в патолого-анатомическом и клиническом отношениях / Маркевич М. // Судебно-медицинская экспертиза. — М.: Изд-во Наркомздрава, 1928. — №8. — С. 8-17.
Проблема истинности современных представлений о сердечно-сосудистых заболеваниях (на примере коронарной патологии) / Витер В.И., Димов А.С., Петрова А.В., Герцен К.А., Юдинцева И.В. // Медицинская экспертиза и право. — 2011. — №1. — С. 19-24.
больше материалов в каталогах
Болезни системы кровообращения
Ишемическая болезнь сердца
Источник
Этиология инфаркта миокарда
1. тромбоз атеросклеротической бляшки – 95 %
2. коронароспазм
3. эмболия коронарной артерии
4. врождённые дефекты развития коронарных артерий
5. приобретённые поражения коронарных артерий
Ведущую роль играет атеросклеротический процесс в коронарных артериях – ИБС, сопровождаемый изъязвлением бляшки, развитием тромбоза и последующим перекрытием просвета коронарной артерии, что приводит к ишемии и некрозу участка сердечной мышцы.
Ишемия миокарда приводит к различным механизмам, оказывающим повреждающее действие на миокард:
1) прекращение кровоснабжения ведёт к снижению образования АТФ, что резко снижает сократительную способность миокарда
2) значительное уменьшение поступления с кровью в миокард энергетических субстратов и кислорода активизирует анаэробные процессы, растёт ацидоз, что снижает сократительную способность
3) дефицит АТФ ведёт к раскрытию калиевых каналов, в итоге происходит выход калия из клеток, снижается потенциал внутренней поверхности клеточной мембраны и нарушается сократимость кардиомиоцитов, также нарушается работа водителей ритма, что создает благоприятные условия для возникновения аритмий
4) нарушается выход кальция из клеток, что ведёт к ишемической контрактуре кардиомиоцитов, чреватой нарушением диастолического расслабления миоцитов
5) снижение активности работы калий-натрий-АТФазы из-за дефицита АТФ приводит к накоплению натрия внутри клеток, что ведёт к их отёку и повреждению
Патоморфология
Типы ИМ:
1. трансмуральный
зона повреждения охватывает всю мышечную стенку сердца
2. нетрасмуральный
зона некроза ограничивается определенными участками миокарда
-субэпикардиальный инфаркт
-субэндокардиальный инфаркт
-интрамуральный инфаркт
– на ранних этапах ( в течение первых 3х часов) в световой микроскоп никаких изменений выявить нельзя, изменения носят субклеточный характер.
– через 3 часа – при окрашивании миокарда солями тетразолия можно дифференцировать ишемизированный миокард ( светлый, бледный ) от нормального (сине-фиолетовый)
– через 6-8 часов – обычная световая микроскопия позволяет выявить паралитическое расширение капилляров и стаз в них, выраженный интерстициальный отек миокарда, набухание волокон
– через 24 часа – макроскопические изменения: зона инфаркта выглядит как участок с неправильными границами, глинисто-красного цвета, отечного, окруженного полоской кровоизлияний.
– через 5 дней – удаление некротических масс
– через 10 дней – в зоне некроза появляется молодая грануляционная ткань, миокард истончен.
– через месяц – зона инфаркта полностью замещается соединительной тканью.
Лечение инфаркта миокарда
Основные группы медикаментозных препаратов
1. наркотические анальгетики (морфин)
показаны на ранних этапах, оказывают вазодилятирующее и стойкое анальгезирующее действие
2. вазодилятаторы
-нитроглицерин, изосорбита динитрат – если АД в норме
-нитропруссид натрия – если АД высокое
Механизм:
Нитраты уменьшают венозный застой в легких без снижения сердечного выброса и повышения потребности миокарда в кислороде.
NB нитраты применяют применяют в том случае если устранена гиповолемия.
3. ингибиторы АПФ – снижают АД и нагрузку на сердце
4. антиагреганты – Клопидогрель – препятствуют тромбообразованию
5. антикоагулянты – Гепарины – препятствуют тромбообразованию
6. диуретики
показаны при ОСН с задержкой жидкости, вв вводят петлевые диуретики (лазикс, диувер)- снижение ОЦК и нагрузки на сердце
7. бета-адреноблокаторы
снижение ЧСС и нагрузки на сердце
8. инотропные препараты
9. тромболитики
восстанавливают кровоток
Лечение больного
| Rp.: Sol. Morphini 1%- 1ml D.t.d.N. 6 in amp. S. п/к 1мл однократно | Наркотический анальгетик, для снятия болевого шока и вазодилятации |
| Rp.: Sol. Heparini 5ml ( a 5000 ED) D.t.d. N. 10 in amp. S.вв 20 000 ЕД в первый день, затем вм по 10 000 ЕД 4 раза в день в течение 5 дней под контролем времени свертываемости. | Антикоагулянт прямого типа действия, для профилактики тромбозов. |
| Rp.: Tab. Aspirini 0,25 D.S. Внутрь. | Антиагрегант, для предотвращения тромбоза |
| Rp.: Tab. Enalaprili 0,01 N 20 D.S. По 1 таблетке внутрь 2 раза в день. | Ингибитор АПФ |
| Rp.: Tab. Metoprololi 0,025 N 50 D.S. По 1 таблетке 2 раза в день. | бета-адреноблокатор, для снижения нагрузки на миокард |
| Rp.: Tab. “Simvastol” № 14 D. S. Внутрь по одной таблетке вечером | статин, для снижения холестерина |
| Rp.: Tab. Clopidogreli 0,075 obd. D.t.d.N. 14 S. Внутрь 1 таблетку 1 раз в сутки | антиагрегант |
| Rp.: Alteplasae 0,05 D.t.d.N. 10 S. Содержимое флакона растворить физраствором. 10 мг в/в струйно, затем – 50 мг в виде в/в инфузии в течение первого часа, с последующей в/в инфузией 10 мг в течение 30 мин до достижения в течение 3 ч максимальной дозы 100 мг. | фибринолитик, для растворения образовавшегося тромба |
Прогноз заболевания
Прогноз заболевания благоприятный в случае соблюдения диеты, режима и медикаментозного лечения. Возможно работа при не сильных физических нагрузках.
Профилактика
Устранить факторы риска:
-отказаться от курения
-снизить или нормализовать массу тела
-снизить потребление алкогольных напитков менее 30г алкоголя в сутки у мужчин и менее 20г в сутки у женщин
-увеличить физические нагрузки – регулярные аэробные (по 30-40 минут не менее 4 раз в неделю) занятия
-изменить режим питания с увеличением потребления растительной пищи, увеличение в рационе калия, кальция в овощах и магния в молочных продуктах, а также уменьшение потребления животных жиров, уменьшения потребления поваренной соли
-снизить потребление жидкости до 1,5литров в день
Выписной эпикриз
Больной Блащик Павел Витольдович, 42 года, поступил 1 ноября 2009 г в плановом порядке, предъявляя жалобы на одышку при физической нагрузке. За день до поступления больной перенёс приступ острых болей за грудиной давящего характера, возникший в постели. Состояние улучшилось, когда больной встал и вышел на балкон. Повторное ухудшение состояния при принятии больным горизонтального положения. Боли не купировались приемом нитроглицерина и диклофенака.
При поступлении в стационар больному была выполнена ЭКГ, на которой была картина трансмурального нижнебокового инфаркта миокарда левого желудочка. Больной был госпитализирован. В дальнейшем у больного развилась атриовентрикулярная блокада 2 стадии 1 типа.
Объективно больной повышенного питания, размеры относительной сердечной тупости расширены влево на 1 см, аускультативно в легких жесткое дыхание, в остальном без существенных отклонений. Больной длительное время курит.
Данные лабораторно-инструментальных методов обследования: в клиническом анализе крови выявлена нормохромная анемия, лейкоцитоз, ускорение СОЭ, из биохимического анализа – гипертриглицеридемия, гиперхолестеринемия, гипокальциемия. Положительный тропониновый тест. Положительные маркеры некротического процесса в миокарде – КФК МВ, аминотрансферазы, миоглобин. Из анализа мочи – пиурия, микрогематурия. На ЭКГ закономерная динамика нижнебокового Q инфаркта миокарда левого желудочка, увеличение интервала PQ. Больному выполнена коронарография, выявлена окклюзия правой коронарной артерии.
18 числа у больного случился рецидив инфаркта миокарда в той же зоне. Больному выполнена ангиопластика и операция стентирования.
Клинический диагноз:
Осн.: ИБС, острый Q инфаркт миокарда нижнебоковой стенки левого желудочка 1 тип от 01.11.09, рецидив в той же зоне от 18.11.09, ангиопластика и стентирование правой коронарной артерии и левой нисходящей ветви от 19.11.09.
Осл.: Атриовентрикулярная блокада II степени I типа. Хроническая сердечная недостаточность I стадии, II ФК по NYHA
Соп.: Нормохромная анемия. Хронический бронхит вне обострения.
Дневник
| дата | объективное состояние | назначения |
| 2 ноября | больной жалуется на слабость, одышку при нагрузке; состояние удовлетворительное; АД 135 на 85, пульс 72, ритмичный. Тоны сердца ритмичные, приглушены. Шумов нет. Аускультативно в легких жесткое дыхание, хрипов нет. | ЭКГ, общий анализ крови, биохимический анализ крови, тропонин, анализ крови на гепатиты и микрореакция; симвастол, клопидогрель, аспирин – четвертинку таблетки, эгилок; инфузии гепарина под контролем МНО; альтеплаза внутривенно |
| 5 ноября | больной жалуется на приступы сердцебиения, возникающие несколько раз в день, самостоятельно проходящие через несколько минут; состояние больного близко к удовлетворительному, АД 135 на 80, пульс 74, ритмичный. | ЭКГ, ЭКГ-мониторинг, Эхо-КГ. изадрин, варфарин под контролем МНО, эгилок, симвастол, плавикс |
| 7 ноября | больной активно жалоб не предъявляет; состояние удовлетворительное; АД 135 на 80, пульс 74, ритмичный. | эгилок, плавикс, симвастол |
| 18 ноября | больной отмечает резкое ухудшение состояния, боль за грудиной давящего характера, остро возникшую, иррадиирующую в левую руку, не снимаемую приемом нитроглицерина; | ангиопластика и стентирование; инфузия гепарина, альтеплазы; наркотические анальгетики – морфин; плавикс; |
| 19 ноября | больной отмечает улучшение состояния; активно жалоб не предъявляет; | эгилок, плавикс, симвастол, варфарин под контролем МНО |
Источник
Развитие морфологических изменений во времени при остром ИМ и последующей организации поражения представлено в таблице ниже.
Почти все трансмуральные инфаркты захватывают по меньшей мере часть левого желудочка (в т.ч. свободную стенку и межжелудочковую перегородку) и почти всю зону кровоснабжения окклюзированной артерии, оставляя лишь узкий ободок (0,1 мм) сохранного субэндокардиального миокарда, жизнеспособность которого поддерживается диффузией кислорода и питательных веществ из желудочка.
15-50% ИМ, вызванных обструкцией правой коронарной артерии, распространяются от задней части свободной стенки левого желудочка до смежной стенки правого желудочка. Изолированный инфаркт правого желудочка возникает редко (в 1-3% случаев), как и инфаркт предсердий.
Частота поражения каждой из трех основных артерий и соответствующие области повреждения миокарда, приводящего к инфаркту (при типичной правосторонней доминантной циркуляции):
• передняя нисходящая артерия (40-50%): инфаркт захватывает переднюю стенку левого желудочка поблизости от верхушки, переднюю часть межжелудочковой перегородки, верхушку по окружности;
• правая коронарная артерия (30-40%): инфаркт локализуется в нижней/задней стенке левого желудочка, задней части межжелудочковой перегородки, в некоторых случаях в нижней/задней свободной стенке правого желудочка;
• огибающая артерия (15-20%): инфаркт поражает латеральную стенку левого желудочка, за исключением области у верхушки.
Острый инфаркт миокарда, в основном в заднебоковой стенке левого желудочка,
выявленный гистохимически по отсутствию окрашивания области некроза (стрелка) хлоридом трифенилтетразолия из-за высвобождения дегидрогеназ после гибели клеток.
Обратите внимание на геморрагию из-за разрыва сердца и рубец на месте старого инфаркта (острие стрелки).
Ориентация препарата: задняя стенка сердца вверху.
Встречаются и другие локализации коронарных поражений, вызывающих инфаркт, например поражение левой основной коронарной артерии, вторичных ветвей передней нисходящей артерии или маргинальных ветвей левой огибающей артерии.
Макро- и микроскопическая картина инфаркта миокарда (ИМ) зависит от продолжительности жизни пациента после события. Области повреждения подвергаются последовательным прогрессирующим морфологическим изменениям, которые начинаются с типичного ишемического коагуляционного некроза (преобладающий механизм клеточной смерти при ИМ, хотя возможен также апоптоз) и переходят в воспаление и репарацию, протекающие очень сходно с ответом тканей на повреждение в других участках организма.
Диагностика острого инфаркта миокарда (ИМ) на ранней стадии (как прижизненная, так и посмертная) может быть затруднена, особенно если смерть наступила в первые несколько часов после появления симптомов. При макроскопическом исследовании изменения обнаруживают в случае смерти пациента через 12 час после начала ИМ, но если пациент умер через 2-3 час, то возможно определить область некроза, погрузив срез миокарда в раствор хлорида трифенилтетразолия.
Такое гистохимическое окрашивание придает красно-коричневый цвет интактному, не пораженному миокарду, где сохраняется активность дегидрогеназ (в частности, лактатдегидрогеназы). Поскольку дегидрогеназы высвобождаются из мертвых клеток через поврежденные мембраны, область инфаркта остается неокрашенной, бледной зоной. Через 12-24 час ИМ можно идентифицировать макроскопически на поперечных срезах как область синевато-коричневого цвета из-за застоя крови.

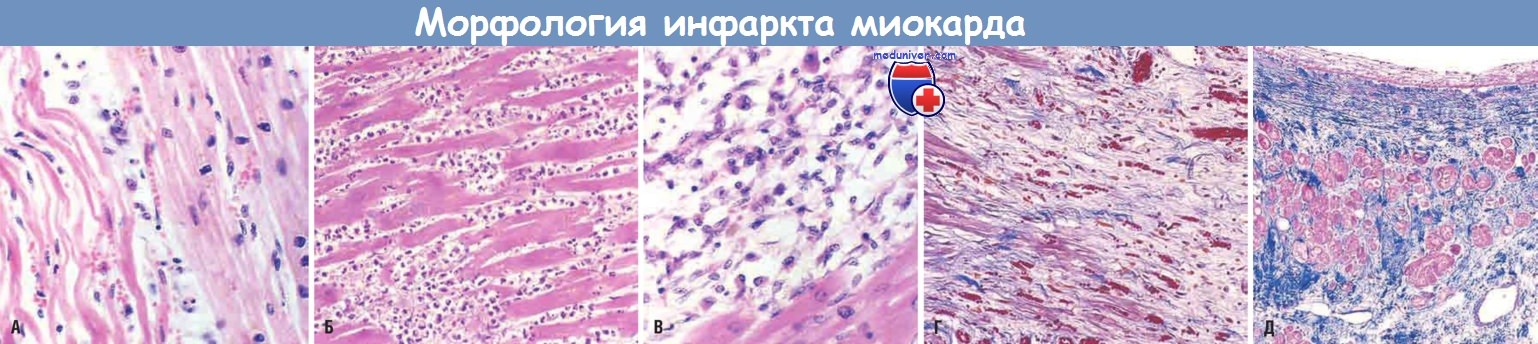
Микроскопическая картина инфаркта миокарда и стадии его репарации.
(А) Через сутки после инфаркта. Видны коагуляционный некроз и извитые кардиомиоциты (удлиненные и узкие по сравнению с расположенными справа сохранными кардиомиоцитами).
Расширенные пространства между погибшими клетками содержат отечную жидкость и нейтрофилы.
(Б) Через 3-4 сут после инфаркта. Плотный полиморфно-ядерный лейкоцитарный инфильтрат в области острого инфаркта миокарда.
(В) Через 7-10 сут после инфаркта. Почти полное удаление некротических клеток путем фагоцитоза.
(Г) Грануляционная ткань характеризуется присутствием рыхлого коллагена и обилием капилляров.
(Д) Заживший инфаркт с замещением некротических клеток плотным коллагеновым рубцом.
Видны немногочисленные оставшиеся кардиомиоциты.
После 24 час миокард в области инфаркта становится дряблым, желтовато-коричневого цвета, а зона ИМ приобретает более четкие границы. Через 10-14 сут зону ИМ окаймляет зона гиперемии из высоковаскуляризованной грануляционной ткани. На протяжении последующих недель у выжившего пациента в пораженной области формируется рубец.
Последовательность развития гистологических изменений вполне предсказуема. Типичные изменения, свойственные коагуляционному некрозу, можно увидеть при микроскопическом исследовании в первые 6-12 час после ИМ. На периферии зоны инфаркта могут присутствовать так называемые волны извитости.
Такие изменения, вероятно, обусловлены интенсивным воздействием сокращающихся жизнеспособных кардиомиоцитов на прилегающие к ним погибшие кардиомиоциты, которые растягиваются с образованием извитости. По краям инфаркта можно обнаружить сублетальные ишемические изменения — вакуольную дегенерацию, или миоцитолиз, — в виде крупных внутриклеточных вакуолей, содержащих, вероятно, воду. Некротические клетки вызывают острое воспаление, достигающее максимума за 1-3 сут.
После этого макрофаги удаляют некротические кардиомиоциты (этот процесс наиболее выражен на 3-7-е сутки), и область повреждения постепенно замещается высоковаскуляризованной грануляционной тканью (наиболее интенсивный процесс идет в течение 1-2 нед). По мере заживления грануляционная ткань замещается фиброзной. В большинстве случаев рубцевание завершается к концу 6-й недели, однако эффективность репарации зависит от размеров поражения.
В процессе заживления участвуют воспалительные клетки, мигрирующие в область повреждения через интактные кровеносные сосуды, которые часто сохраняются только по краям инфаркта. Именно поэтому репарация идет от краев инфаркта к его центру. Инфаркт в конце процесса репарации может оказаться неоднородным по структуре — заживление наиболее выражено на периферии. Как только репарация повреждения завершается, возраст рубца определить невозможно: плотный рубец спустя 8 нед после инфаркта и через 10 лет после него будет выглядеть одинаково.
Инфаркт может распространяться за пределы первоначальной границы в течение нескольких дней или недель в результате рецидивирующего некроза в прилегающих областях (расширение инфаркта). В подобных случаях присутствует центральная область, где заживление произошло раньше (т.е. оно более выражено), чем на периферии инфаркта. Этим процесс расширения инфаркта отличается от описанной ранее картины простого инфаркта, когда репарация на периферии опережает таковую в центре инфаркта.
Расширение инфаркта может произойти в результате ретроградного распространения тромба, проксимального сосудистого спазма, приводящего к недостаточному кровотоку через участок умеренного стеноза, ухудшения сократимости сердца, отложения микроэмболов, состоящих из тромбоцитов и фибрина, или аритмий, нарушающих функцию сердца.

– Рекомендуем ознакомиться со следующей статьей “Механизмы развития (патофизиология) реперфузии инфаркта миокарда”
Оглавление темы “Патогенез ишемической болезни сердца”:
- Механизмы развития (патофизиология) ишемической болезни сердца
- Механизмы развития (патофизиология) стенокардии
- Механизмы развития (патофизиология) инфаркта миокарда
- Различия трансмурального и субэндокардиального инфаркта миокарда
- Морфология инфаркта миокарда
- Механизмы развития (патофизиология) реперфузии инфаркта миокарда
- Клиника и маркеры инфаркта миокарда
- Механизмы развития (патогенез) осложнений инфаркта миокарда
- Механизмы развития (патогенез) хронической ИБС
- Механизмы развития (патогенез) внезапной сердечной смерти
Источник
