Генетические аспекты инфаркта миокарда
Автор – Е.В.Чарикова
Термин инфаркт миокарда ведет свое начало от латинского слова
“infarctus (infarcire)” – набивать, наполнять, втискивать и
греческих слов “mys, my(os)” – мышца + “kardia” –
сердце.
Инфаркт миокарда – заболевание, обусловленное некрозом участка сердечной
мышцы вследствие острой
ишемии
, чаще всего связанной с закупоркой какой-либо ветви коронарных артерий
сердца тромбом. Иногда инфаркт миокарда развивается вследствие спазма
коронарной (венечной) артерии, закупорки ее эмболом,
атеросклеротической бляшкой
при кровоизлии в ее основаниении, крайне редко – в результате разрыва
патологически измененной коронарной артерии.
Инфаркт миокарда может рассматриваться как осложнение различных
заболеваний, сопровождающихся острой коронарной недостаточностью. Наиболее
часто инфаркт миокарда развивается у больных с атеросклерозом коронарных
артерий. В современной классификации инфаркт миокарда рассматривается как
самостоятельная болезнь – острая и наиболее тяжелая форма
ишемической болезни сердца
.
В последнее время все больше внимания уделяется роли генов (генетической
предрасположенности) в развитии инфаркта миокарда.
Так, в 2001 году группа исследователей (
Femandez-Arcas N.,2001
) исследовала роль трех полиморфных генов: ангиотензиногена (
AGT
), ангиотензин превращающего энзима (
ACE
), рецептора ангиотензин-II 1 типа (
AT1R
) ренин-ангиотензивной системы (
РАС
(RAS) – renin-angiotensin system) как независимых факторов риска инфаркта
миокарда и их корреляцию с тремя высокими факторами риска заболевания –
холестерином сыворотки
(CH) крови,
гипертонией
(HT) и
курением
(SM). Было установлено, что частота “T” аллеля гена
ангиотензина значительно выше у лиц с инфарктом миокарда с высоким уровнем
холестерина (CH), гипертонией (HT) и курящих (SM). Частота “M”
аллеля гена ангиотензина значительно выше у лиц с инфарктом миокарда без
вышеперечисленных показателей. На основе своих исследований авторы сделали
вывод: “M” аллель – независимый фактор риска для инфаркта
миокарда, “T” аллель модифицирует риск заболеваемости, когда
другие факторы риска присутствуют (высокий уровень холестерина сыворотки,
гипертония, курение).
Другая группа исследователей (
Cine N.,2002
) изучала взаимосвязь между полиморфизмом повтора из 27 пар нуклеотидов в
4 интроне
гена ecNOS
и инфарктом миокарда в субгруппе турецкой популяции. Пациенты с инфарктом
миокарда с генотипом a/a составляют 4,3%, с генотипом a/b – 26,6%, с
генотипом b/b – 69,1%. В контрольной группе частота генотипов a/a – 0,6%,
a/b -18,0%, b/b – 81,4%. Таким образом, авторы пришли к заключению, что
инфаркт миокарда ассоциирован только с одним субтипом полиморфизма гена
ecNOS.
К настоящему времени растет количество доказательств в пользу ДНК
повреждений мутагенами, обнаруженными в табачном дыме, и тем самым
обусловливающим развитие сердечно-сосудистых заболеваний (
Botto N.,2001
), в частности инфаркта миокарда. Так, в исследованиях, проведенных
учеными Канады и США (
Cornelis M.C.,2004
) было установлено, что полиморфизм гена цитохрома P450
CYP1A2
увеличивает риск возникновения инфаркта миокарда. Перед тем как связаться
с ДНК, многие мутагены подвергаются метаболической активации цитохромом
P450 CYP1A1 или CYP1A2.
CYP1A1
активирует полициклические
ароматические углеводороды
, а CYP1A2 активирует
ароматические амины
(
Shou M.,1996
;
Hammons G.J.,1997
;
Turesky R.J.,1998
).
Гены, кодирующие эти ферменты, локализуются на 15 хромосоме человека и их
индукция регулируется
арилгидрокарбонатным рецептором
(
Bock K.W.,1994
;
Harper P.A.,2002
).
Генетический полиморфизм (SNP) генов P450 CYP1A1 или P451 CYP1A2
ассоциирован с измененной индуцибельностью ферментов, и объясняет различную
чувствительность индивидуумов к табачному дыму и связанному с ним
заболеванием сердца. Замена нуклеотидов (A-T) в 3801 положении в
3’некодирующей области гена CYP1A1 увеличивает индуцибельность фермента (
Landi M.T.,1994
), а замена нуклеотидов (A-C) в первом интроне в позиции -163 гена
CYP1A2F1 ассоциирована со сниженной индуцибельностью фермента как результат
дифференцированного связывания регуляторных белков (
Sachse C.,1999
;
Chida M.,1999
).
Полиморфизм генов мутаген-активирующих ферментов, модифицирующих
чувствительность к табачному дыму, как к канцерогену была показана в более
ранних исследованиях. В последние годы была продемонстрирована такая же
завимость и опасность возникновения на основе той же причины и инфаркта
миокарда (
Cornelis M.C.,2004
;
Wang X.L.,1985
).
Полиморфизм
R92Q генa tumour necrosis factor receptor 1
также ассоциирован с преждевременным инфарктом миокарда (
Poirier O.,2004
).
Группа французских исследователей полагает, что полиморфный вариант Pro715
P-селектина
играет защитную роль от возникновения инфаркта миокарда (
Herrmann S.M.,1998
;
Tregouet D.A.,2002
). Повышенная экспрессия P-селектина отмечается в атеросклеротических
бляшках и это позволяет предполагать роль P-селектина в развитии
атеросклероза и коронарных заболеваний сердца.
В
гене P-селектина
идентифицировано 13 полиморфизмов: пять в 5′-фланкирующей области гена и
восемь в экзонах, четыре из которых определяют замену аминокислот
(ser290asn, asn562asp, leu599val, thr715pro, T741T (A/G) (
Herrmann S.M.,1998
;
Tregouet D.A.,2002
). Полиморфизм P-селектина (ser290asn), как и полиморфизм Е-селектина
(ser128arg; G98T) ассоциированы с увеличенным риском преждевременных
коронарных заболеваний сердца (
Herrmann S.M.,1998
;
Tregouet D.A.,2002
;
Zheng F.,2001
).
Представляют интерес данные о том, что полиморфизм P-селектина (pro715)
играет защитную роль в возникновении инфаркта миокарда (
Herrmann S.M.,1998
;
Tregouet D.A.,2002
).
Смотрите также:
Источник
1. Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med, 2006; 3: e442.
2. Thom T, Haase N, Rosamond W et al. Heart disease and stroke statistics – 2006 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation, 2006; 113: e85–151.
3. European Cardiovascular Disease Statistic, 2000 edition. British heart Foundation.
4. Oganov R. G., Kontsevaya A. V., Kalinina A. M. Economic damage from cardio-vascular diseases in Russian Federation. Cardiovascular therapy and prevention 2011; 10 (4): 4–9. Russian (Оганов Р. Г. Концевая А. В., Калинина А. М. Экономический ущерб от сердечно-сосудистых заболеваний в Российской Федерации. Кардиоваскулярная терапия и профилактика 2011; 10 (4): 4–9.)
5. Shalnova S.A, Deev A. D. The mortality trend in Russia at beginning of XXI century official data). Cardiovascular therapy and prevention 2011; 10 (6): 5–10. Russian (Шальнова С. А., Деев А. Д. Тенденции смертности в России в начале XXI века (по данным официальной статистики). Кардиоваскулярная терапия и профилактика 2011; 10 (6): 5–10.)
6. World Health Organization. The world health report 2002 – reducing risk, promoting healthy life. Geneve, 2002.
7. Yusuf S, Hawken S, Ounpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet, 2004; 364: 937–952.
8. Chow CK, Islam S, Bautista L et al. Parental history and myocardial infarction risk across the world: The INTERHEART study. J Am Coll Cardiol, 2011; 57: 619–627.
9. Cardiovascular prevention. Russian recommendation. Cardiovascular therapy and prevention 2011; 6 (Suppl.2) 64p. Russian (Кардиоваскулярная профилактика. Российские рекомендации ВНОК. Кардиоваскулярная терапия и профилактика. 2011. № 6. Приложение 2. 64 с.)
10. Graham I, Atar D, Borch-Jonsen K et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Eur Heart J, 2007; 28: 2375–2414.
11. Mayer B, Erdmann J, Schunkert H. Genetics and heritability of coronary artery disease and myocardial infarction. Clin Res Cardiol, 2007; 96: 1–7.
12. Schunkert H, Erdmann J, Samani NJ. Genetics of myocardial infarction: a progress report. Eur Heart J, 2010; 31 (8): 918–925.
13. Kathiresan S, Melander O, Anevski D et al. Polymorphisms associated with cholesterol and risk of cardiovascular events. N Engl J Med, 2008; 358: 1240–1249.
14. Linsel-Nitschke P, Gotz A, Erdmann J et al. Lifelong reduction of LDL-cholesterol related to a common variant in the LDL-receptor gene decreases the risk of coronary artery disease – a Mendelian Randomisation study. PLoS One, 2008; 3: e2986.
15. Willer CJ, Sanna S, Jackson AU et al. Newly identified loci that influence lipid concentrations and risk of coronary artery disease. Nat Genet, 2008; 40: 161–169.
16. Malygina N. A., Kostomarova I. V., Melentiev I. A. et al. Molecular-genetics markers for clinical prognosis of ischemic heart disease in old patients. Russ J Cardiol 2009; 78 (4): 68–72. Russian (Малыгина Н. А., Костомарова И. В., Мелентьев И. А. и др. Молекулярно-генетические маркеры для прогноза течения ишемической болезни сердца у больных старших возрастных групп. Российский кардиологический журнал 2009; 78 (4): 68–72.)
17. Nazarenko G. I., Kleimenova E. B., Yanus V. M. et al. Coronary angiography results and genetic markers in patient with CAD. Heart 2009; 8 (1): 38–43. Russian (Назаренко Г. И., Клейменова Е. Б., Янус В. М. и др. Сопоставление результатов ангиографии коронарных артерий и генетических маркеров у пациентов с ИБС. Сердце 2009; 8 (1): 38–43.)
18. Pardo Perales G. D., Voitovich A. N., Bogdanova M. A. et al. Polymorphisms L55M and Q192R of paraoxanase 1 gene in patient with coronary heart disease and different age and gender. Arterial hypertension 2009; 15 (1): 97–102. Russian (Пардо Пералес Г. Д., Войтович А. Н., Богданова М. А. и др. Полиморфизм L55M и Q192R в гене параоксаназы 1 у больных ишемической болезнью сердца разного пола и возраста. Артериальная гипертензия 2009; 15 (1): 97–102.)
19. Gonchar A. L., Mosse I. B., Ivanov A. A. et al. Polymorphisms of the hemostasis genes and it role in myocardial infarction development. Arterial hypertension 2009; 15 (4): 466–469. Russian (Гончар А. Л., Моссэ И. Б., Иванов А. А. и др. Полиморфные варианты генов системы тромбообразования и их роль в развитии инфаркта миокарда. Артериальная гипертензия 2009; 15 (4): 466–469.)
20. Pavlova T. V., Polyakov V. P., Duplyakov D. V. et al. The distribution of some hemostasis genes polymorphisms in patient with coronary heart disease. Cardiology 2009; 4: 9–13 Russian (Павлова Т. В., Поляков В. П., Дупляков Д. В. и др. Распределение полиморфизмов генов некоторых компонентов системы гемостаза у больных ишемической болезнью сердца. Кардиология 2009; 4: 9–13.)
21. Pchelina S. N., Sirotkina O. V., Sheidina A. M. et al. Genetic risk factors of myocardial infarction in young man in North-Western region of Russia. Cardiology 2007; 7: 29–34. Russian (Пчелина С. Н., Сироткина О. В., Шейдина А. М. и др. Генетические факторы риска инфаркта мио-карда у мужчин молодого возраста, проживающих в северо-западном регионе России. Кардиология 2007; 7: 29–34.)
22. Grigorieva L. V., Fedorova S. A., Mustafina O. E. et al. VNTR-polymorphism of intron 4 gene of eNOS and it’s association with myocardial infarction in Yakut population. Medical genetic 2006; 5 (11): 40–44. Russian (Григорьева Л. В., Федорова С. А., Мустафина О. Е. и др. VNTR-полиморфизм интрона 4 гена эндотелиальной синтетазы оксида азота и анализ ассоциаций с инфарктом миокарда в якутской популяции. Медицинская генетика 2006; 5 (11): 40–44.)
23. Kosyankova T. V., Puzyrev K. V. NO-synthetases polymorphisms: investigation in Siberian population and in patient with cardio-vascular disease. Bulletin of Siberian Branch of RAMS 2003; 107 (1): 6–11. Russian (Косянкова Т. В., Пузырев К. В. Полиморфизм генов синтетаз азота: исследование в сибирских популяциях и у больных сердечно-сосудистой патологией. Бюллетень СО РАМН 2003; 107 (1): 6–11.)
24. Popova L. V., Nikolaev K.Yu., Nikolaeva A. A. et al. Clinical characteristics of myocardial infarction and polymorphisms of gene e-NOS. Clinical medicine 2008; 4: 32–35. Russian (Попова Л. В., Николаев К. Ю., Николаева А. А. и др. Особенности клинического течения инфаркта миокарда при полиморфизмах гена эндотелиальной NO-синтетазы. Клиническая медицина 2008; 4: 32–35.)
25. Devrishbekova Z. M., Ivanchenko D. N., Katelnitskaya L. I. Genetic risk factors of myocardial infarction. Disease prevention and health strengthening 2008; 2: 9–12. Russian (Девришбекова З. М., Иванченко Д. Н., Кательницкая Л. И. Генетически обусловленные факторы риска развития инфаркта миокарда. Профилактика заболеваний и укрепление здоровья 2008; 2: 9–12.)
26. Konenkov V. I., Rakova I. G., Maksimov V. N. et al. Allel polymorphisms of pro-and anti-inflammation genes in patient with myocardial infarction in Europeans mens. Bulletin of Siberian Branch of RAMS 2006; 120 (2): 56–62. Russian (Коненков В. И., Ракова И. Г., Максимов В. Н. и др. Аллельный полиморфизм генов про- и противовоспалительных цитокинов при инфаркте миокарда в европеоидной популяции мужчин. Бюллетень СО РАМН 2006; 120 (2): 56–62.)
27. Samani NJ, Burton P, Mangino M et al. A genomewide linkage study of 1,933 families affected by premature coronary artery disease: The British Heart Foundation (BHF) Family Heart Study. Am J Hum Genet, 2005; 77: 1011–1020.
28. Mayer B, Fischer M, Erdmann J et al. Identification of rare forms of autosomal dominant heritability of myocardial infarction. Circulation, 2002; 106: II–290.
29. Meshkov A. N., Stambolskyi D. V., Nikitina L. A. et al. Genetic risk factors of ischemic heart disease in patients with familial hypercholesterolemia. Cardiology 2005; 7: 10–14. Russian (Мешков А. Н., Стамбольский Д. В., Никитина Л. А. и др. Генетические факторы риска развития ишемической болезни сердца у пациентов с семейной гиперхолестеринемией. Кардиология 2005; 7: 10–14.)
30. Van der Net JB, Oosterveer DM, Vermissen J et al. Replication study of 10 genetic polymorphisms associated with coronary heart disease in a specific high-risk population with familial hypercholesterolemia. Eur Heart J, 2008; 29: 2195–2201.
31. Helgadottir A, Thorleifsson G, Manolescu A et al. A common variant on chromosome 9p21 affects the risk of myocardial infarction. Science, 2007; 316: 1491–1493.
32. McPherson R, Pertsemlidis A, Kavaslar N et al. A common allele on chromosome 9 associated with coronary heart disease. Science, 2007; 316: 1488–1491.
33. Samani NJ, Erdmann J, Hall AS et al. Genomewide association analysis of coronary artery disease. N Engl J Med, 2007; 357: 443–453.
34. Schunkert H, Gotz A, Braund P et al. Repeated replication and a prospective meta-analysis of the association between chromosome 9p21.3 and coronary artery disease. Circulation, 2008; 117: 1675–1684.
35. Shen GQ, Li L, Rao S et al. Four SNPs on chromosome 9p21 in a South Korean population implicate a genetic locus that confers high cross-race risk for development of coronary artery disease. Ateroscl Thromb Vasc Biol, 2008; 28: 360–365.
36. Hinohara K, Nakajima T, Takahashi M et al. Replication of the association between a chromosome 9p21 polymorphism and coronary artery disease in Japanese and Korean populations. J Hum Genet, 2008; 53: 357–359.
37. Hiura Y, Fukushima Y, Yuno M et al. Validation of the association of genetic variants on chromosome 9p21 and 1q41 with myocardial infarction in a Japanese population. Circ J, 2008; 72: 1213–1217.
38. Maitra A, Dash D, John S et al. A common variant in chromosome 9p21 associated with coronary artery disease in Asian Indians. J Genet, 2010; 88: 113–118.
39. Saleheen D, Alexander M, Rasheed A et al. Association of the 9p21.3 locus with risk of first-ever myocardial infarction in Pakistanis: case-control study in South Asia and updated meta-analysis of Europeans. Arterioscler Thromb Vasc Biol, 2009; 30: 1467–1473.
40. Broadbent HM, Peden JF, Lorkowski S et al. Susceptibility to coronary artery disease and diabetes is encoded by distinct, tightly linked SNPs in the ANRIL locus on chromosome 9p. Hum Mol Genet, 2008; 17: 806–814.
41. Jarinova O, Stewart AF, Roberts R et al. Functional analysis of the chromosome 9p21.3 coronary artery disease risk locus. Arterioscler Thromb Vasc Biol, 2009; 29: 1671– 1677.
42. Erdmann J, Grosshennig A, Braund PS et al. New susceptibility locus for coronary artery disease on chromosome 3q22.3. Nat Genet, 2009; 41: 280–282.
43. Yoshikawa Y, Satoh T, Tamura T et al. The M-Ras-RA-GEF-2-Rap1 pathway mediates tumor necrosis factor-alpha dependent regulation of integrin activation in splenocytes. Mol Biol Cell, 2007; 18: 2949–2959.
44. Samani NJ, Deloukas P, Erdmann J et al. Large scale association analysis of novel genetic loci for coronary artery disease. Arterioscler Thromb VascBiol, 2009; 29: 774–780.
45. Kathiresan S, Voight BF, Purcell S et al. Genome-wide association of early-onset myocardial infarction with single nucleotide polymorphisms and copy number variants. Nat Genet, 2009; 41: 334–341.
46. Horne BD, Carlquist JF, Muhlestein JB et al. Intermountain Heart Collaborative Study Group. Associations with myocardial infarction of six polymorphisms selected from a three-stage genome-wide association study. Am Heart J, 2007; 154 (5): 969–975.
47. Tregouet DA, Konig IR, Erdmann J et al. Genome-wide haplotype association study identifies the SLC22A3-LPAL2-LPA gene cluster as a risk locus for coronary artery disease. Nat Genet, 2009; 41: 283–285.
48. Patel RS, Su S, Neeland IJ et al. The chromosome 9p21 risk locus is associated with angiographic and progression of coronary artery disease. Eur Heart J, 2010; 31: 3017–3023.
49. Soranzo N, Spector TD, Mangino M. et al. A genomewide meta-analysis identifies 22 loci associated with eight hematological parameters in the HaemGen consortium. Nat Genet, 2009; 41: 1182–1190.
50. Dandona S, Stewart AFR, Chen L et al. Gene dosage of the common variant 9p21 predicts severity of coronary artery disease. J Am Coll Cardiol, 2010; 56: 479–486.
51. Adrissino D, Berzuini C, Merlini PA et al. Influence of 9p21.3 genetic variants on clinical and angiographic outcomes in early-onset myocardial infarction. J Am Coll Cardiol, 2011; 58 (4): 426–434.
52. Voevoda M. I., Maksimov V. N., Kulikov I. V. et al. Polymorphisms obtained in GWA studies and associated with myocardial infarction: verifying in Siberian population. Data of VI Congress of Russian society of medical genetics. Rostov-on-Don. 2010. pp.38–39. Russian (Воевода М. И., Максимов В. Н., Куликов И. В. и др. Полиморфизмы, ассоциированные с инфарктом миокарда, в полногеномных исследованиях. Проверка на сибирской популяции. Материалы VI съезда Российского общества медицинских генетиков. Ростов-на-Дону. 2010. С. 38–39.)
53. Voevoda M. I., Maksimov V. N., Kulikov I. V. et al. Investigation the relation between myocardial infarction and SNP’s associated with myocardial infarction based on GWA data in Russian population. Data of International congress “Cardiology on crossing of the sciences”. Tumen. 2010. pp.72–73. Russian (Воевода М. И., Максимов В. Н., Куликов И. В. и др. Изучение в Российской популяции ассоциации инфаркта миокарда с ОНП, связанны-ми с этим заболеванием по результатам полногеномных исследований. Тезисы международного конгресса «Кардиология на перекрестке наук». Тюмень. 2010. С. 72–73.)
Источник
Цель исследования состояла в изучении взаимосвязи однонуклеотидных полиморфизмов (ОНП) rs499818 (6p24.1), rs619203 гена ROS1 (6q22), rs10757278 и rs1333049 (9p21.3), rs2549513 (16q23.1), rs4804611 гена ZNF627 (19p13.2) с развитием инфаркта миокарда (ИМ) у лиц молодого возраста. Группа больных ИМ (n=99) в возрасте моложе 45 лет и группа контроля (n=111) статистически значимо не различались по полу (р=0,617), возрасту (р=0,291), артериальной гипертонии (р=0,766), сахарному диабету (р=0,395), гиперхолестеринемии (р=0,696), избыточной массе тела и ожирению (р=0,361), абдоминальному типу ожирения (р=0,831) и анамнезу курения (р=0,400). Статистически значимые различия между группами имелись по отягощенной наследственности (р
Хорошо известно, что ишемическая болезнь сердца (ИБС) — заболевание, развивающееся в результате взаимодействия как средовых, так и генетических факторов. Огромное социально-экономическое бремя сердечнососудистых заболеваний (ССЗ) обусловлено не только прямыми затратами на здравоохранение, но и в гораздо большей степени ущербом, связанным с преждевременной смертностью в трудоспособном возрасте [1]. В России, несмотря на постепенное снижение смертности от ССЗ в последние годы — от 927,5 на 100 тыс. человек в 2003 г. до 752,7 на 100 тыс. в 2011 г., ССЗ остаются ведущей причиной смертности среди населения. При этом на первое место ССЗ выходят, начиная с 45-летнего возраста, и абсолютным лидером среди них является ИБС, удельный вес которой в структуре смертности от ССЗ составляет более 50% [2, 3].
Комплекс профилактических мер, наглядно продемонстрировавший свою эффективность по снижению заболеваемости и смертности от ССЗ, не позволяет в полном объеме решать задачи первичной профилактики среди населения молодого и среднего возраста. Во многом это обусловлено сложностью оценки степени риска развития ССЗ в молодом возрасте, в том числе с помощью расчета относительного риска по шкале SCORE [4—7]. У значительного числа пациентов в молодом возрасте ИБС дебютирует развитием инфаркта миокарда (ИМ) с высоким уровнем догоспитальной летальности, в ряде случаев при этом выявляются интактные коронарные артерии [8—10]. Таким образом, проблема профилактики и поиска прогностических маркеров ИМ у лиц молодого и среднего возраста остается крайне актуальной.
В исследованиях последних лет на основе анализа полного генома выявляются все новые однонуклеотидные полиморфизмы (ОНП), ассоциированные с развитием ИБС и ИМ [11]. Однако наиболее строгий и достоверный генетический предиктор развития ИМ, известный к настоящему времени, локализован в хромосоме 9р21.3. Особая роль этого региона генома человека в развитии ИБС и ИМ подтверждена в различных этнических группах и мета-анализах [12—17]. Предикторная роль этого региона генома доказана и в крупном исследовании у женщин различных этнических групп [18].
В ряде исследований выявлена ассоциация хромосомы 9р21.3 с тяжестью поражения коронарного русла. Вероятность тяжелого трехсосудистого поражения в 1,5—2 раза выше была у носителей аллеля риска С rs1333049 [19]. В другом крупном проспективном исследовании аллель риска G rs10757278 достоверно ассоциировался с многососудистым типом поражения, стенозом ствола левой коронарной артерии, проксимальным типом поражения [20].
Выявлена также ассоциация локуса 9р21.3 с развитием ИБС в молодом возрасте [21— 23]. Есть данные о взаимосвязи локуса 9р21.3 с отягощенной наследственностью [24]. Однако лишь в единичных работах проводился жесткий отбор с ограничением возраста больных, перенесших ИМ как наиболее тяжелое проявление ИБС [25]. По нашему мнению, возрастной ценз имеет принципиальное значение. В этом случае можно предполагать большую роль именно генетических, а не средовых факторов, взаимодействие которых и реализуется в развитие заболевания.
Цель настоящего исследования состояла в изучении взаимосвязи ОНП rs499818 (6p24.1), rs619203 гена ROS1 (6q22), rs10757278 и rs1333049 (9p21.3), rs2549513 (16q23.1), rs4804611 гена ZNF627 (19p13.2) с развитием ИМ у лиц молодого возраста.
Материал и методы
В исследование включали больных, госпитализированных с диагнозом ИМ в крупнейшие кардиологические центры Красноярска — Городская клиническая больница No20 им. И.С. Берзона и Краевая клиническая больница. Критериями включения являлись: 1) верифицированный на основании клинической картины, электрокардиографических данных и исследования маркеров некроза миокарда диагноз ИМ; 2) возраст ≤ 45 лет; 3) европеоидная раса; 4) наличие подписанного информированного согласия пациента. Исследование одобрено Этическим комитетом Красноярского государственного медицинского университета.
За период с 01.01.09 по 30.06.10 в исследование были включены 99 больных ИМ (90 мужчин и 9 женщин) в возрасте от 22 до 45 лет (средний возраст 39,9±5,1 года). Группу контроля составили 111 человек (103 мужчины и 8 женщин) в возрасте от 25 до 45 лет (средний возраст 40,7±4,7 года). Группы статистически значимо не различались по возрасту (р=0,291) и полу (р=0,617).
 Контрольная группа была сформирована на основе выборки из базы крупного эпидемиологического исследования ВОЗ MONICA по изучению тенденций заболеваемости и смертности от ССЗ и определяющих их факторов, выполненного в НИИ терапии СО РАМН Новосибирска. Объем выборки из генеральной совокупности определялся протоколом программы и составил около 800 мужчин и 800 женщин в возрасте 25—64 года. Каждая возрастная декада (25—34 года, 35—44 года, 45—54 года, 55—64 года) включала около 200 человек. Из общей когорты участников программы была сформирована группа контроля, включающая 111 человек в возрасте моложе 45 лет, с исключенной ИБС на основании стандартного опросника Rose. Программа обследования всех участников включала измерение артериального давления, антропометрию (рост, масса тела, окружность талии), анамнез курения, исследование уровня общего холестерина, семейный анамнез ИБС, 12-канальную электрокардиограмму покоя.
Контрольная группа была сформирована на основе выборки из базы крупного эпидемиологического исследования ВОЗ MONICA по изучению тенденций заболеваемости и смертности от ССЗ и определяющих их факторов, выполненного в НИИ терапии СО РАМН Новосибирска. Объем выборки из генеральной совокупности определялся протоколом программы и составил около 800 мужчин и 800 женщин в возрасте 25—64 года. Каждая возрастная декада (25—34 года, 35—44 года, 45—54 года, 55—64 года) включала около 200 человек. Из общей когорты участников программы была сформирована группа контроля, включающая 111 человек в возрасте моложе 45 лет, с исключенной ИБС на основании стандартного опросника Rose. Программа обследования всех участников включала измерение артериального давления, антропометрию (рост, масса тела, окружность талии), анамнез курения, исследование уровня общего холестерина, семейный анамнез ИБС, 12-канальную электрокардиограмму покоя.
Группа больных ИМ статистически значимо не отличалась от контрольной группы по таким общепризнанным факторам риска ИБС, как наличие артериальной гипертонии (р=0,766), сахарного диабета (р=0,395), гиперхолестеринемии (р=0,696), избыточной массы тела и ожирения (р=0,361), абдоминального типа ожирения (р=0,831) и анамнез курения (р=0,400). Гиперхолестеринемию диагностировали при уровне общего холестерина более 5,0 ммоль/л. При определении избыточной массы тела и ожирения использовали классификацию ВОЗ, основанную на вычислении индекса массы тела (ИМТ) по формуле Кетле — масса тела (кг)/рост (м)2. Нормальной считали массу тела при ИМТ 18,5—24,9 кг/м2, избыточную массу тела констатировали при ИМТ 25,0—29,9 кг/м2, ожирение — при ИМТ ≥30 кг/м2. Абдоминальный тип ожирения диагностировали при окружности талии более 94 см у мужчин и 80 см у женщин. Исследуемая группа и группа контроля статистически значимо различались по отягощенной наследственности по ИБС (р<0,001). Характеристика групп представлена в табл. 1.
Молекулярно-генетические исследования. Геномную ДНК выделяли из 10 мл венозной крови. Экстракцию ДНК из крови проводили фенолхлороформным методом [26]. Полиморфизм генов тестировали с помощью полимеразной цепной реакции в режиме реального времени в соответствии с протоколом фирмы производителя (зонды TaqMan, «Applied Biosystems», США) на приборе AB 7900HT. В исследовании изучали ОНП rs499818 (6p24.1), rs619203 гена ROS1 (6q22), rs10757278 и rs1333049 (9p21.3), rs2549513 (16q23.1), rs4804611 гена ZNF627 (19p13.2), ассоциированные с развитием ИМ по данным полногеномных исследований (табл. 2).
Статистическая обработка. Полученные данные обрабатывали при помощи программы SPSS, версия 19.0. Описательная статистика результатов исследования представлена для качественных признаков в виде процентных долей и их стандартных ошибок, для количественных — в виде средних арифметических (М) и стандартных отклонений (σ). Значимость различий качественных признаков оценивали при помощи непараметрического критерия χ2 Пирсона с поправкой на непрерывность и точного критерия Фишера. Проверку нормальности распределения значений переменных осуществляли с использованием критерия Колмогорова—Смирнова. При подтверждении нормального распределения переменных проверку статистической значимости различий проводили при помощи t-критерия Стьюдента для независимых выборок. В отсутствие нормального распределения переменных проводили сравнение групп с помощью непараметрического рангового критерия Манна—Уитни. Для оценки риска развития ИМ по конкретному аллелю или генотипу определяли отношения шансов (ОШ) в таблицах сопряженности 2×2 с расчетом доверительных интервалов (ДИ). Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
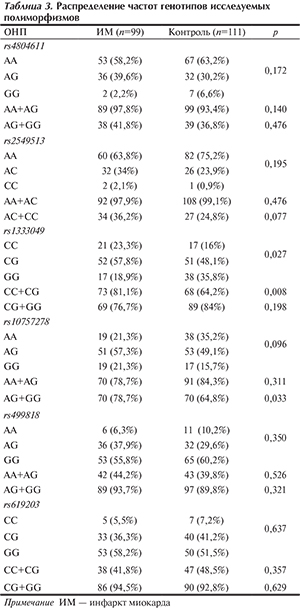 По результатам исследования ассоциация с ИМ выявлена для двух ОНП rs1333049 и rs10757278 локуса 9р21.3. При анализе распределения частот генотипов исследуемых полиморфизмов было определено, что аллель риска С (генотипы CС + СG) rs1333049 и аллель риска G (генотипы AG + GG) rs10757278 достоверно ассоциировались с ИМ. В группе ИМ выявлено 81,1% носителей аллеля С rs1333049, в контрольной группе — 64,2% (р=0,008). Частота аллеля G rs10757278 в группе больных ИМ была также статистически значимо выше (78,7%), чем в контрольной, — 64,8% (р=0,033). Нами не обнаружено статистически значимых различий между группами по распределению частот различных вариантов генотипов ОНП rs4804611, rs2549513, rs499818, rs619203. Результаты представлены в табл. 3.
По результатам исследования ассоциация с ИМ выявлена для двух ОНП rs1333049 и rs10757278 локуса 9р21.3. При анализе распределения частот генотипов исследуемых полиморфизмов было определено, что аллель риска С (генотипы CС + СG) rs1333049 и аллель риска G (генотипы AG + GG) rs10757278 достоверно ассоциировались с ИМ. В группе ИМ выявлено 81,1% носителей аллеля С rs1333049, в контрольной группе — 64,2% (р=0,008). Частота аллеля G rs10757278 в группе больных ИМ была также статистически значимо выше (78,7%), чем в контрольной, — 64,8% (р=0,033). Нами не обнаружено статистически значимых различий между группами по распределению частот различных вариантов генотипов ОНП rs4804611, rs2549513, rs499818, rs619203. Результаты представлены в табл. 3.
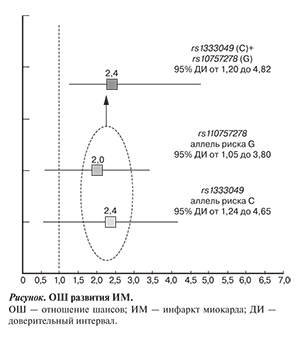
Нами выявлено, что у носителей аллеля риска С rs1333049, в отличие от лиц с генотипом GG, ОШ в 2,4 раза выше (ОШ 2,40 при 95% ДИ от 1,24 до 4,65). В 2 раза больший риск имелся и у носителей аллеля риска G rs10757278 по сравнению с гомозиготным АА rsв1а3р3и30а4н9т(оCм)+ генотипа (ОШ 2,00 при 95% ДИ от 1,05 до 3,80).
Теоретически при наличии у одного человека аллелей риска одновременно в 2 ОНП можно предполагать более высокий риск развития заболевания. Однако для этого должен соблюдаться целый ряд условий. Одно из таких условий — независимая передача потомству или отсутствие сцепления. В нашем случае rs1333049 и rs10757278 расположены достаточно близко – на расстоянии 1025 нуклеотидных пар. ОШ развития ИМ при наличии обоих аллелей риска С rs1333049 и G rs10757278 составило 2,40 (при 95% ДИ от 1,202,д4о 4,82) и не отличалось от такового при наличии только аллеля С rs1333049 (см. рисунок).
 Вероятно, эти ОНП в нашей популяции входят в один блок сцепления и, соответственно, достаточно генотипирования одного ОНП. Блоки сцепления могут различаться в разных популяциях. Это и служит одной из главных причин расхождений результатов ассоциативных исследований в разных популяциях. Что касается изучаемых ОНП rs1333049 и rs10757278, то почти полное их сцепление можно отметить и в других недавно опубликованных работах [24, 31].
Вероятно, эти ОНП в нашей популяции входят в один блок сцепления и, соответственно, достаточно генотипирования одного ОНП. Блоки сцепления могут различаться в разных популяциях. Это и служит одной из главных причин расхождений результатов ассоциативных исследований в разных популяциях. Что касается изучаемых ОНП rs1333049 и rs10757278, то почти полное их сцепление можно отметить и в других недавно опубликованных работах [24, 31].
Учитывая, что единственным различием между группами ИМ и контроля был отягощенный по ИБС семейный анамнез, мы проанализировали взаимосвязь ОНП хромосомы 9р21.3 с отягощенной наследственностью. По нашим данным, предикторная роль ОНП хромосомы 9р21.3 была независимой от наличия семейного анамнеза.
Более того, риск развития ИМ в группе без отягощенного по ИБС семейного анамнеза был существенно выше, чем в общей группе. Так, ОШ развития ИМ у носителей аллеля риска С rs1333049 составило 4,25 (при 95% ДИ от 1,39 до 12,99), у носителей аллеля риска G rs10757278 несколько меньше — 3,04 (при 95% ДИ от 1,09 до 8,52).
Впервые в России у лиц молодого возраста проведено изучение ОНП, ассоциированных с развитием ИМ по данным полногеномных исследований. Доказано, что ОНП rs1333049 и rs10757278 локуса хромосомы 9р21.3 являются предикторами развития ИМ в молодом возрасте вне зависимости от наличия традиционных факторов риска, в том числе отягощенной наследственности. При этом суммирование генотипов риска ОНП rs1333049 и rs10757278 локуса 9р21.3 не имеет большего прогностического значения перед одним из них — rs1333049.
Практическим приложением геномной информации может быть ее использование в стратификации риска у пациентов. Интеграция генетических предикторов в имеющиеся шкалы оценки риска и разработка клиникогенетических рискометров являются одним из наиболее перспективных направлений в определении индивидуального риска развития заболевания. Ввиду постоянства генотипа в течение жизни изучение генетических предикторов ИМ наиболее актуально именно у лиц молодого возраста.
- Оганов Р.Г., Концевая А.В., Калинина А.М. Экономический ущерб от сердечно-сосудистых заболеваний в Российской Федерации. Кардиоваск тер и проф 2011;4:4—9.
- Оганов Р.Г., Масленникова Г.Я. Демографические тенденции в Российской Федерации: вклад болезней системы кровообращения. Кардиоваск тер и проф 2012;1:5—10.
- Федеральная служба государственной статистики https://www.gks. ru/wps/wcm/connect/rosstat_main/rosstat/ru/statistics/population/ demography
- Зволинская Е.Ю., Александров А.А. Оценка риска развития сердечнососудистых заболеваний у лиц молодого возраста. Кардиология 2010;8:37—47.
- Кардиоваскулярная профилактика. Российские рекомендации ВНОК. Кардиоваск тер и проф 2011;6(Приложение 2):64.
- Журавлев Ю.И., Назаренко Г.И., Рязанов В.В. и др. Новый метод анализа риска развития ишемической болезни сердца на основании геномных и компьютерных технологий. Кардиология 2011;2:19—25.
- Осипов А.Г., Силкина С.Б., Правдина Е.А. и др. Факторы риска и относительный коронарный риск у лиц молодого возраста. Кардиоваск тер и проф 2012;1:41—42.
- Гафаров В.В., Громова Е.А., Гафарова А.В. и др. Инфаркт миокарда и стресс на работе и в семье: 10-летний риск возникновения в открытой популяции мужчин 25—64 лет (эпидемиологическое исследование в рамках программы ВОЗ «MONICA-PSYCHOSOCIAL»). Кардиология 2011;3:10—16.
- Голофеевский В.Ю., Сотников А.В., Яковлев В.В. и др. Особенности течения инфаркта миокарда в молодом и среднем возрасте. Клин мед 2009 2:21—24.
- Сафарова М.С., Ежов М.В., Лупанов В.П. и др. Инфаркт миокарда у молодого мужчины без классических факторов риска атеросклероза. Кардиоваск тер и проф 2010;5:86—90.
- Schunkert H., König I.R., Kathiresan S. et al. Large-scale association analyses identifies 13 new susceptibility loci for coronary artery disease. Nat Genet 2011;43:333—338.
- Максимов В.Н., Куликов И.В., Орлов П.С. и др. Проверка взаимосвязи между девятью однонуклеотидными полиморфизмами и инфарктом миокарда на сибирской популяции. Вестн РАМН 2012;5:24—29.
- Franceschini N., Carty C., Buzkova P. et al. Association of genetic variants and incident coronary heart disease in multiethnic cohorts: the PAGE study. Circ Cardiovasc Genet 2011;4:661—672.
- Hiura Y., Fukushima Y., Yuno M. et al. Validation of the association of genetic variants on chromosome 9p21 and 1q41 with myocardial infarction in a Japanese population. Circ J 2008;72:1213—1217.
- Koch W., Türk S., Erl A. et al. The chromosome 9p21 region and myocardial infarction in a European population. Atherosclerosis 2011;217:220—226.
- Maitra A., Dash D., John S. et al. A common variant in chromosome 9p21 associated with coronary artery disease in Asian Indians. J Genet 2010;88:113—118.
- Shen G.Q., Rao S., Martinelli N. еt al. Association between four SNP’s on chromosome 9p21 and myocardial infarction is replicated in an Italian population. J Hum Gen 2008;53:144—150.
- Beckie T.M., Groer M.W., Beckstead J.W. The relationship between polymorphisms on chromosome 9p21 and age of onset of coronary heart disease in black and white woman. Gen Test Moll Biomark 2011;15:435— 442.
- Dandona S., Stewart A.F.R., Chen L. et al. Gene dosage of the common variant 9p21 predicts severity of coronary artery disease. J Am Coll Cardiol 2010;56:479—486.
- Patel R.S., Su S., Neeland I.J. et al. The chromosome 9p21 risk locus is associated with angiographic and progression of coronary artery disease. Eur Heart J 2010;31:3017—3023.
- Chen Z., Qian Q., Ma G. et al. A common variant on chromosome 9p21 affects the risk of early-onset coronary artery disease. Mol Biol Rep 2009;36:889—893.
- Ellis K.L., Pilbrow A.P., Frampton C.M. et al. A common variant at chromosome 9p21.3 is associated with age of onset of coronary disease but not subsequent mortality. Circ Cardiovasc Genet 2010;3:286—293.
- McPherson R. Chromosome 9p21 and coronary artery disease. N Engl J Med 2010;362:1736—1737.
- Scheffold T., Kullmann S., Huge A. et al. Six sequence variants on chromosome 9p21.3 are associated with a positive family history of myocardial infarction: a multicenter registry. BMC Cardiovascular Disorders 2011;11:9.
- Adrissino D., Berzuini C., Merlini P.A. et al. Influence of 9p21.3 genetic variants on clinical and angiographic outcomes in early-onset myocardial infarction. J Am Coll Cardiol 2011;58:426—434.
- Смит К., Калко С., Кантор Ч. Пульс-электрофорез и методы работы с большими молекулами ДНК. Анализ генома. Под ред. К. Дейвиса (пер. с англ.). М: Мир 1990:58—94.
- Мартынова Е.А., Демкина А.И., Шестерня П.А. Генетические предикторы развития инфаркта миокарда. Сб. тез. I Всерос. науч.практ. конф. молодых ученых по профилактике и лечению сердечнососудистых заболеваний. Барнаул 2012:42—43.
- Shiffman D., Ellis S.G., Rowland C.M. et al. Identification of four gene variants associated with myocardial infarction. Am J Hum Genet 2005;77:596—605.
- Larson M.G., Atwood L.D., Benjamin E.J. et al. Framingham Heart Study 100K project: genome-wide associations for cardiovascular disease outcomes. BMC Med Genet 2007;8:S5.
- Koch W., Hoppmann P., Schömig A. et al. Variations of specific noncandidate genes and risk of myocardial infarction: a replication study. Int J Cardiol 2011;147:38—41.
- Virani S.S., Brautbar A., Lee V.V. et al. Chromosome 9p21 single nucleotide polymorphisms are not associated with recurrent myocardial infarction in patients with established coronary artery disease. Circ J 2012;76:950—956.
ГБОУ ВПО Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого Минздрава РФ
КафРиесдурнаокв.нОуШтрернанзивихтбиоялИезМне. й No1
ОШ — отношение шансов; ИМ — инфаркт миокарда; ДИ —
Шестерня П.А. – к.м.н., доцент кафедры.
доверительный интервал.
Шестерня П.А. … Генетические предикторы ИМ
Шульман В.А. – д.м.н., проф. кафедры.
Никулина С. Ю.- д.м.н., проф., зав. кафедрой, проректор по учебной работе. Мартынова Е.А. – аспирант.
Демкина А.И. – аспирант.
ФГБУ НИИ терапии СО РАМН, Новосибирск
Институт цитологии и генетики СО РАМН, Новосибирск
Воевода М.И. – д.м.н., проф., акад. РАМН, директор Института терапии. Лаборатория молекулярно-генетических исследований терапевтических заболеваний Максимов В.Н. – д.м.н, зав. кафедрой.
Межинститутский сектор молекулярной эпидемиологии и эволюции человека
Орлов П.С. – мл.н.с.
E-mail: shesternya75@mail.ru
Источник
