Европейские рекомендации по ишемическому инсульту 2016
Алгоритм лечения острой фазы ишемического инсульта – Европейские рекомендации
а) Тромболизис. Срочное исследование неврологического статуса и выполнение КТ являются обязательными в каждом случае инсульта произошедшего не более трех часов назад. Если диагноз ишемический инсульт подтверждается и нет противопоказаний для тромболизиса, пациент должен быть передан в отделение интенсивной терапии инсульта и немедленно должна быть начата тромболитическая терапия — тканевыми активаторами плазминогена (доза 0,9 мг/кг, максимальная доза 90 мг, 10% дозы в виде болюса, затем 60 мин внутривенная инфузия оставшейся дозы).
Противопоказания к проведению тромболитической терапии: внутримозговая гематома, давность инсульта более трех часов, неизвестной давности инсульт, субарахноидальное кровоизлияние, NIHSS <4 или быстрый регресс неврологического дефицита, NIHSS >25 или быстрое нарастание неврологических симптомов, ишемия головного мозга более трети региона СМА на КТ, ранее существовавший серьезный неврологический дефицит, повторный инсульт в течение трех месяцев, внутримозговое кровоизлияние в анамнезе, заболевания мозга в анамнезе (опухоли, аневризмы и др.), геморрагическая ретинопатия, геморрагический диатез, печеночная недостаточность, декомпенсированный сахарный диабет, хирургические процедуры или серьезные травмы в течение трех месяцев, международное нормализованное отношение (МНО) > 1,7; тромбоциты < 100000/мм3. Эффект внутривенного тромболизиса описан в течение 4,5 ч после инсульта.
Интраартериальный тромболизис может стать альтернативным вариантом у пациентов с проксимальной окклюзией СМА и давностью менее шести часов. Показания не обоснованы рандомизированным исследованием. Лечение должно проводиться по протоколу клинического многоцентрового исследования. Механическая эмболэктомия является новым вариантом лечения острой окклюзии церебральных сосудов (например, Merci Retriever). Проводится рандомизированное исследование случаев инсульта до 8 часов, в которых тромболизис не показан.
Основным преимуществом метода является низкий риск внутричерепного кровотечения. Еще одним новым вариантом для клинической фазы вмешательства является ускорение окклюзированной реканазализации сосудов с ТКД. Тромболизис выполняется у 15% пациентов с острым инсультом в США, в Европе показатель зависит от страны (0,5-3%).
б) Распределение по срокам:
1. Чрезвычайные ситуации (в диапазоне десятков минут). Тромболизис, декомпрессия задней ямки при масс-эффекте вызванном инфарктом мозжечка.
2. Срочные (диапазон нескольких дней). Каротидная эндартерэктомия или стентирование для симптоматических стенозов ВСА. При выявлении больших ишемических поражений на КТ хирургические вмешательства/стентирование должны быть отложены примерно на шесть недель (из-за риска геморрагического преобразования ишемического поражения).
3. Отсроченные (диапазон – недели). Другие сосудистые операции.
в) Консервативное лечение. Следующие методы лечения могут применяться при остром инсульте при возможности проведения тромболизиса: гемодилюция (как правило, кристаллоиды в сочетании с коллоидами, глюкозу не следует вводить в течение первых двух дней из-за риска лактат ацидоза в области ишемического поражения). Венепункция может быть необходима при уровнях гематокрита более 0,5 и неэффективности гемодилюции. Можно назначить гепарин (два раза в день 5000 ME подкожно) или низкомолекулярные гепарины. Влияние ноотропных препаратов подтвердились не полностью.
Первичная профилактика:
1. Артериальная гипертензия. Артериальная гипертензия является наиболее важным модифицируемым фактором риска. При систолическом давлении, превышающим 160 мм рт.ст. и диастолическом давлении, превышающем 90 мм рт. ст. значительно увеличивается риск ишемического инсульта. Связь между увеличением артериального давления и риском инсульта является линейной. Артериальное давление должно быть около 140/90 мм рт.ст., у пациентов с сахарным диабетом—130/85 мм рт.ст.
2. Курение. Патофизиологические последствия курения являются многофакторными, эластичность красных кровяных клеток уменьшается, уровень фибриногена увеличивается, агрегация тромбоцитов увеличивается, уровень гематокрита растет. Курение повышает риск ишемического инсульта в два раза.
3. Другие факторы риска: диабет, гиперинсулинемия, и резистентность к инсулину. Другие атерогенные факторы риска часто встречаются среди инсулин-зависимых пациентов, особенно гипертоников, а также у пациентов, страдающих ожирением и дислипидемией (синдром X). В этих случаях типичной является гиперинсулинемия с резистентностью к инсулину. Строгая коррекция уровня глюкозы является обязательной, к гипертонии также следует относиться серьезно (с использованием ингибиторов АПФ).
4. Фибрилляция предсердий. Мерцание предсердий является серьезным фактором риска инсульта (примерно 3-5%). Инсульт, вызванный эмболией из сердца, встречается примерно у 70% пациентов с фибрилляцией предсердий. Существует тесная взаимосвязь между фибрилляцией предсердий, возрастом и риском инсульта. Антикоагулянтная или антиагрегантная терапия проводятся для начальной профилактики инсульта у пациентов с фибрилляцией предсердий. К другим заболеваниям сердца, также повышающим риск инсульта, относятся стеноз митрального клапана, пролапс митрального клапана, искусственные клапаны, дилятационная кардиомиопатия, открытое овальное окно, дефект межжелудочковой перегородки и аневризмы предсердий.
5. Гиперлипидемия. Дисбаланс уровня жиров в крови связан с повышенным риском инсульта. Лечение статинами снижает риск атеросклеротической болезни экстракраниальных сосудов. Пациентам с гиперлипидемией должна быть назначена соответствующая диета, при ишемической болезни сердца и повышении уровня ЛПНП однозначно рекомендуется лечение статинами.
6. Другие факторы риска. Ожирение, гипергомоцистеинемия, наркомания, гиподинамия, наличие антифосфолипидных антител, заместительная гормональная терапия в климактерическом периоде у женщин и прием пероральных противозачаточных средств.
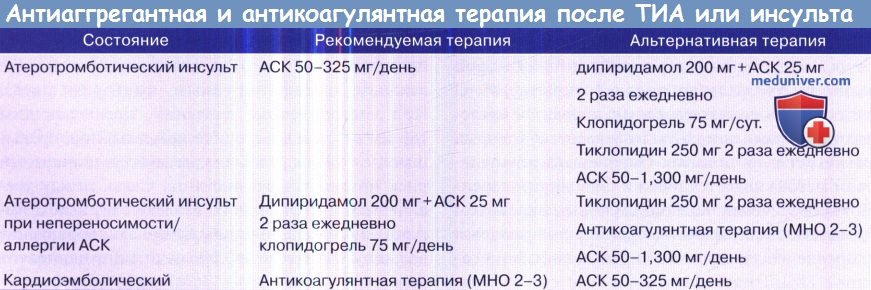
Вторичная профилактика. Воздействие на факторы риска является обязательным. Антикоагулянтная терапия показана пациентам с сердечно-эмболическим инсультом (от сердца к артерии) и фибрилляции предсердий (МНО в пределах 2-3). Антиагрегантная терапия ацетилсалициловой кислотой (АСК) показана (доза 50-325 мг/сут.), если антикоагулянты противопоказаны. Антиагрегантная терапия показана пациентам с атеротромботическими состояниями экстракраниальных сосудов или при инсульте неизвестного происхождения.
1. Ацетилсалициловая кислота. Доза 50-325 мг/сутки приемлема, поскольку идеальный вариант неизвестен. Управление по контролю за продуктами и лекарствами (США) рекомендует упомянутый диапазон; для вторичной профилактики предпочтительнее полная доза 325 мг/сутки.
2. Тиклопидин. В последнее время тиклопидин стал применяться реже из-за побочных эффектов, особенно нейтропении. Частота побочных эффектов на 10% ниже среди афроамериканцев, и серьезной нейтропении у них не наблюдалось.
3. Клопидогрель. Клопидогрель химически близок к тиклодипину. Эффективность эквивалентна тиклопидину и АСК. Основным преимуществом этого препарата является низкая частота побочных эффектов.
4. Комбинация дипиридамола, ингибиторов фосфодиэстеразы и АСК, ингибиторов циклооксигеназы. Теоретически такая комбинация дает преимущество по сравнению с приемом одного препарата.

Учебное видео тромболизиса при инфаркте миокарда
При проблемах с просмотром скачайте видео со страницы Здесь
– Также рекомендуем “Алгоритм анестезии при сужении сосуда головного мозга – Европейские рекомендации”
Оглавление темы “Болезни сосудов головного мозга.”:
- Алгоритм лечения ишемии мозга с масс-эффектом – Европейские рекомендации
- Алгоритм лечения острой фазы ишемического инсульта – Европейские рекомендации
- Алгоритм анестезии при сужении сосуда головного мозга – Европейские рекомендации
- Алгоритм диагностики спонтанного кровоизлияния в мозг – Европейские рекомендации
- Алгоритм лечения спонтанного кровоизлияния в мозг – Европейские рекомендации
- Алгоритм диагностики артерио-венозных шунтов мозга у детей – Европейские рекомендации
- Алгоритм диагностики внутричерепных аневризм у детей – Европейские рекомендации
Источник
Выход в свет новой редакции рекомендаций по лечению и профилактике инсульта и транзиторных ишемических атак (ТИА), подготовленной совместно экспертами Европейской инсультной ассоциации (ESA) и Европейской инициативной группы против инсульта (EUSI), стал одним из главных событий XVII европейской конференции по проблеме инсульта, которая состоялась в мае текущего года в г. Ницца (Франция). Русский перевод полного текста рекомендаций подготовлен одним из ведущих российских экспертов по проблеме острых нарушений мозгового кровообращения – доктором медицинских наук, профессором В.И. Скворцовой. Неврологи, которым в основном адресован этот номер газеты, найдут его в виде отдельной брошюры.
I.Больше внимания в новых рекомендациях уделено телемедицине, подчеркивается, что дистанционная передача телеметрической информации о состоянии пациента способна обеспечить более эффективное взаимодействие всех медицинских служб и существенно ускорить госпитализацию инсультных больных.
II.Особый акцент сделан на проблеме транзиторных нарушений кровоснабжения мозга. Подчеркнуто, что экстренная госпитализация и оценка состояния пациентов с подозрением на ТИА позволяет впоследствии снизить риск развития инсульта. Рекомендации по экстренной доставке пациентов с ТИА в инсультное отделение, их обследованию с использованием нейровизуализации и немедленному лечению являются новыми для Европы. В разделе «Диагностика» дополнительно уточнены показания к проведению нейровизуализации: экстренная КТ- или МР-ангиография мозговых сосудов теперь показана всем пациентам с ТИА, малым инсультом и спонтанным регрессом симптоматики.
III.Некоторые изменения коснулись раздела по первичной профилактике инсульта. Снова снизилась планка целевого артериального давления, теперь это 120/80 мм рт. ст., то есть речь идет о нормализации этого показателя путем изменения образа жизни и назначения агрессивной гипотензивной терапии. Целевое значение холестерина плазмы крови принято на уровне 3,9 ммоль/л.
IV.В главе о модификации образа жизни появились новые для нас сведения об отсутствии профилактического эффекта от приема витаминов, антиоксидантов и гормональной заместительной терапии у женщин (то же для вторичной профилактики). Зато упоминаются результаты исследования, в котором показано, что умеренное потребление алкоголя (12-24 г/сут в пересчете на чистый этанол) уменьшает риск инсульта. Из напитков для такой профилактики рекомендуется красное вино.
V.Несколько изменились представления о возможностях антитромбоцитарной терапии в первичной профилактике инсульта. Ацетилсалициловая кислота (АСК) в низких дозах – до 100 мг/сут – рекомендована женщинам, но профилактический эффект от ее назначения минимален. У мужчин же АСК продемонстрировала способность снижать риск инфаркта миокарда, но не инсульта. Другие антитромбоцитарные препараты также не рекомендуются для первичной профилактики инсульта. У пациентов с фибрилляцией предсердий следует учитывать риск развития инсульта при принятии решения о назначении АСК или варфарина. Малые дозы АСК для снижения риска инсульта рекомендуется назначать пациентам с асимптомным стенозом внутренней сонной артерии более 50%.
VI.По результатам последних исследований, операции на сонных артериях не рекомендованы пациентам со значимым асимптомным стенозом (60-99%), за исключением пациентов, имеющих высокий риск развития инсульта, обусловленный нестабильностью бляшки. Этого условия не было в предыдущей редакции рекомендаций. Каротидная ангиопластика, с установкой стента или без, не рекомендована пациентам с асимптомным каротидным стенозом. Результаты исследования эффективности операций на сонных артериях у пациентов с асимптомным стенозом показали, что, несмотря на снижение риска развития ипсилатерального инсульта и инсульта в целом, абсолютное преимущество оперативного лечения мало (около 1% в год), тогда как частота интраоперационного инсульта или смерти составляет 3%. Указано, что консервативное лечение остается предпочтительным для большинства асимптомных лиц, и только в центрах с уровнем интраоперационных осложнений 3% и менее рассматривается возможность хирургического вмешательства.
VII.Антиагреганты – АСК, клопидогрель, дипиридамол, трифлюзал и их комбинации – заняли еще более прочные позиции в схемах вторичной профилактики инсульта. В новых рекомендациях уточнены показания к назначению антиагрегантов и пероральных антикоагулянтов. Отмечено, что пожилой возраст не является препятствием для применения варфарина, а при наличии строгих противопоказаний в качестве альтернативы предлагается комбинация низких доз АСК и дипиридамола, хотя эта рекомендация имеет класс доказательности IV.
VIII.Новыми в разделе «Вторичная профилактика» стали рекомендации по лечению расстройств дыхания во время сна, таких как синдром сонных апноэ, с использованием аппаратуры для поддержания постоянного положительного давления в дыхательных путях. У больных с криптогенным инсультом рекомендовано эндоваскулярное закрытие открытого овального окна.
IX.Раздел «Базисная терапия инсульта» практически не изменился, хотя несколько расширилась глава по питанию больных, ведению пациентов с нейрогенной дисфагией и ее распознаванию.
X.У пациентов с острым ишемическим инсультом не рекомендовано раннее назначение нефракционированного гепарина, низкомолекулярных гепаринов и гепариноидов из-за преобладания риска кровоизлияний над пользой от их применения. Антикоагулянты показаны только пациентам с высоким риском тромбоза глубоких вен нижних конечностей для предупреждения развития тромбоэмболии легочных артерий.
XI.Остается в силе рекомендация о назначении всем пациентам 325 мг АСК в первые 48 ч от начала развития инсульта. Отмечено, что исследований по применению клопидогреля, дипиридамола или их комбинации в остром периоде ишемического инсульта не проводилось.
XII.Новые данные получены в отношении лечения отека мозга – одной из основных причин смерти пациентов с ишемическим инсультом, в частности уточнены показания к хирургической декомпрессии и вентрикулостомии. Гипотермия мозга не подтвердила свою эффективность в отношении лечения отека, как и прежде, не рекомендованы при этом состоянии кортикостероиды.
XIII.В разделе о профилактике и лечении осложнений инсульта отмечена нецелесообразность профилактического назначения антибиотиков без подтверждения наличия инфекции.
XIV.В новых рекомендациях подробно описывается преемственность реабилитации инсультных больных от инсультного отделения до амбулаторного этапа. По реабилитации до сих пор не проведено доказательных исследований, поэтому все реабилитационные мероприятия (лечебная физкультура, эрготерапия, физиотерапия, акупунктура и пр.) по-прежнему рекомендуются, но класс рекомендаций невысокий.
Источник
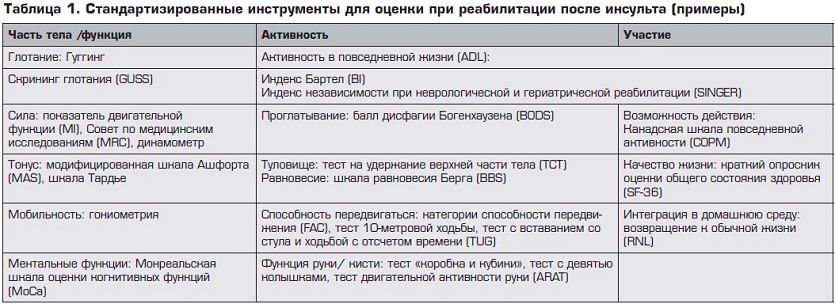
Драматическая статистика инсульта – пугающая распространенность (более полумиллиона человек ежегодно в России испытывают острое нарушение мозгового кровообращения), его высокая летальность (123 на 100 000 населения), значительная инвалидизация (56–81%) и социальная дезадаптация1 пациентов определили особое положение в современном здравоохранении и повышенное внимание со стороны медицинской общественности к его проблемам. И прежде всего к реабилитации пациентов, перенесших его, – справедливо считаемой чрезвычайно важной, сложной и дискуссионной.
Постинсультная реабилитация – совокупность мер и методов, нацеленных на продолжение лечения, начатого в остром периоде, и способствующих устранению или компенсированию повреждений после инсульта.
В последние годы появилось достаточно данных, подтвержденных серьезными исследованиями, ставших причиной отхода специалистов от разработанной ранее GRADE-концепции (модели преемственной помощи) и других рекомендуемых принципов2 в пользу новых, делающих ставку на грамотную организацию инсультного отделения, которая позволяет снижать смертность и инвалидизацию именно за счет того, что в таком отделении проводятся не только диагностика и терапия, но и всесторонние реабилитационные мероприятия.
Акцентируют внимание врачей на острую необходимость постинсультной реабилитации и последние международные рекомендательные документы – Rehabilitation 2030 (ВОЗ), Report on Stroke in Europe (Европейского альянса по инсульту). Еще один документ ВОЗ (Global Stroke Bill of Rights) представляет реабилитацию и социальную реинтеграцию как основное право пациента после инсульта.3
Новые отношения к ведению пациентов, перенесших острое нарушение мозгового кровообращения, отражают последние (2018 г.) Рекомендации Американской ассоциации сердца/Американской ассоциации инсульта (American Heart Association/American Stroke Association) по раннему уходу за пациентами с острым ишемическим инсультом.4
Интересным и значимым событием стал и выход в 2018 году Австрийского руководства (Клинические рекомендации по реабилитации после инсульта).5 Согласно этому документу, цель реабилитации – «начать общие и специфические методы лечения как можно раньше, сразу после терапии в реанимации, чтобы помочь пациенту быстрее вернуться к прежней жизни или заново адаптироваться к окружающему пространству, социальной среде».
Сегодня становится все более очевидным, что реабилитация должна начинаться в первые 24–48 часов от развития инсульта, проводиться в отделении неотложной терапии и основываться на индивидуальном подходе, комплексной оценке, обоснованности выбора диагностических, лечебных методов. Основная регламентация реабилитационных мероприятий сегодня связана с Международной классификацией функционирования, жизнедеятельности и здоровья (МФК). Реабилитационные активности различаются по уровню (структурный, функциональный), по целям, видам и степени активности пациента. Мероприятия должны быть релевантными состоянию больного (уровень доказательности A), легко измеряться и подстраиваться под пациента, иметь достаточный мотивационный компонент.

И конечно же она требует наличия мультидисциплинарной команды, в которую, помимо невролога и физиотерапевта, должны войти логопед, психолог, эрготерапевт, социальный работник, другие специалисты.
Важный аспект реабилитации – физическая активность. В постинсультном периоде она снижает инвалидизацию, повышает кардиореспираторную толерантность к ходьбе, улучшает когнитивные функции и настроение, повышает работоспособность, а также влияет на другие аспекты, связанные с инсультом (уровень В). Комплексы физических упражнений должны разрабатываться для всех перенесших инсульт пациентов (кто способен их выполнять) вместе с программами по кардиореабилитации. Пациентам также должны предлагаться способы логопедической коррекции и когнитивные тренинги.
Хорошие результаты дают различные виды реабилитации в поликлинике, дневном стационаре или на дому в течение первого года после выписки больного из клиники. Далеко не последнее место занимает здесь и активное вовлечение в реабилитационный процесс родственников, близких для больного людей.
Эти основополагающие принципы позволяют снижать степень инвалидизации, повышать качество жизни пациентов и помогают более быстрой адаптации – и личной, и бытовой, и социальной, и профессиональной.6
Важную роль в этом подходе играет также медикаментозная нейрореабилитация, выстроенная на принципах доказательной медицины. Последние годы дали достаточно доказательств того, что защита нейрососудистой структуры от ишемического повреждения имеет первостепенное значение. Появилась и возможность применения современных репаративных лекарственных средств (терапия стволовыми клетками, моноклональными антителами). К этой группе относятся и экстракты из биологических тканей животных, другие ускорители восстановления.7 Новые возможности сегодня позволяют изучать патофизиологические процессы на молекулярном уровне, а это означает, что необходимо переоценить те исследования эффективности существующих нейропротекторов, которые были проведены с менее высокой степенью точности.7
Серьезного внимания требует и поздняя реабилитация после инсульта (после года). Стойкое нарушение жизнедеятельности организма ведет к дальнейшему ухудшению и сопутствующим дисфункциям. Спастичность, болевой синдром, парестезии, изменения температурной чувствительности часто развиваются только на этапе хронизации. Целевые физические тренировки для верхних конечностей пациентов, для развития равновесия и ходьбы оказывали положительный эффект даже спустя год (и более) после инсульта.8 Важно отметить и значение профессиональной реабилитации, которая для работающих пациентов – необходимый фактор для возвращения к полноценной жизни.
Перед началом реабилитации в течение первых 48 часов должна проводиться терапевтическая оценка. Оцениваются конкретные функциональные ограничения каждого пациента по отдельным системам организма и их функциональному состоянию, по уровню активности больного, его взаимодействию с социальной средой.9 После этого определяется набор соответствующих инструментов для достижения поставленных целей реабилитации (уровень B).
Медикаментозная терапия и нейровосстановление
С точки зрения экспертов, готовящих Австрийское руководство по реабилитации после инсульта,5 как и многих их зарубежных коллег, сегодня необходимо серьезное внимание обращать на такие понятия, как нейрорепарация, нейропластичность и нейровосстановление. Сам механизм развития заболевания ставит перед врачами важнейшую задачу – максимально раннее предотвращение смерти нейронов (нейропротекция) и затем реорганизацию нейрональных сетей, таким образом, обеспечивая преемственность между нейропротекцией и нейровосстановлением.
Медикаментозная терапия объективно способна ускорять нейровосстановление (нейропротективную терапию, цитопротекцию, метаболическую защиту мозга). Этот процесс сложен и разнообразен, отражает многогранность механизмов ишемического повреждения ткани мозга.10 Основные ее направления – антиоксидантная терапия, торможение местной воспалительной реакции (антагонисты провоспалительных цитокинов и молекул клеточной адгезии), улучшение трофического обеспечения мозга (нейротрофины), нейроиммуномодуляция (нейропептиды), регуляция рецепторных структур (ганглиозиды).11 Сегодня есть данные о положительном влиянии леводопы,12 специфических пептидных комплексов (Церебролизина).13–15
Действие последнего препарата стоит рассмотреть подробнее. В прошлом году он был включен в стандарты реабилитационных мероприятий после инсульта в Австрии.5
Институт инсульта Австрии признал возможности нейротрофической поддержки в реабилитации пациентов после инсульта. Клинические рекомендации по реабилитации содержат единственный нейротрофический препарат – Церебролизин (ЭВЕР Фарма Йена ГмбХ) (с уровнем доказательности II,B)5.
Особенность препарата, по мнению специалистов, заключается в том, что механизм его действия не ограничивается только нейропротекцией, его основное действие – модуляция эндогенного восстановления головного мозга после повреждения.
Как известно, естественная защитная реакция мозга в первые минуты ишемии – синтез нейротрофических факторов (и рецепторов к ним). Именно их высокий уровень обеспечивает регресс неврологического дефицита даже при сохранении вызвавшего его морфологического дефекта. Нейротрофическими и ростовыми свойствами обладают эндогенные низкомолекулярные нейрополипептиды, избирательно действующие на центральные холинергические нейроны, демонстрирующие нейропротективные, репаративные и пролиферативные эффекты. Они свободно преодолевают ГЭБ, их физиологическая активность во много раз выше, чем непептидных соединений. При этом они (в зависимости от места высвобождения) могут осуществлять разнообразные функции: медиаторную, модулятора реактивности определенных групп нейронов, регулятора тканевого метаболизма и многие другие.16
Нейротрофической активностью в полной мере обладает комплекс специфических пептидов – Церебролизин®. В его составе уникальное сочетание 24 нейропептидов и 17 L-аминокислот. Исследователи установили специфические трофическую и модуляторную функции каждого из этих компонентов,17 объясняющие способность препарата повышать выживаемость клеток мозга в условиях прекращения их нейротрофической поддержки со стороны клеток-мишеней, недостаточности кислорода и глюкозы (на уровне клеток – предотвращение повреждения дендритов).16,18
За более чем 60-летнюю историю (зарегистрирован в 1954 г. в Австрии) препарат участвовал в огромном числе клинических исследований, став единственным ноотропным пептидергическим препаратом с доказанной нейротрофической активностью, аналогичной таковой у естественных факторов роста нервов, но проявляющейся в условиях периферического введения.20 Большие и ограниченные, международные и отечественные исследования многократно доказывали его безопасность и эффективность при ишемическом инсульте как в острую стадию, так и в период реабилитации (а также при хронической нейродегенеративной и церебральной патологии).13-15, 17-26
И исследования продолжаются, в прошлом году профессором Натаном Борнштейном и его коллегами26 были опубликованы результаты большого метаанализа. Под их пристальное внимание попало 9 клинических исследований (по дизайну все: проспективные, рандомизированные, двойные слепые, плацебоконтролируемые) с оценкой эффективности этого ноотропного препарата в отношении улучшения общего неврологического состояния пациентов на ранних этапах после перенесенного инсульта (препарат в дозе 30–50 мл/1 раз в сутки в течение 10–21 дня).
В резюме проведенного метаанализа отмечены:
- Величина эффекта (непараметрический критерий MW) при проведении оценки с помощью шкалы тяжести инсульта NIHSS на 30 день (или 21) при обобщении результатов 9 РКИ указывала на большую эффективность данного препарата по сравнению с плацебо (MW 0,60; P
- Наиболее выраженные эффекты были отмечены в исследованиях с исходной высокой степенью тяжести инсульта – по шкале NIHSS: MW = 0,64; P = 0,0001.
- Совокупное NNT для клинически значимых изменений при проведении ранней оценки по шкале NIHSS составляло 7,7 (95% ДИ: 5,2–15,0).
- В предварительно запланированном развернутом ранговом анализе оценки по шкале mRS на 90-й день у пациентов с заболеванием умеренной и тяжелой степени был получен MW 0,61, свидетельствующий о статистически значимой большей эффективности препарата (95% ДИ 0,52-0,69; P = 0,0118; N = 314; процедура обобщения Вэй-Лачин [MERT]).
- Во всех анализах чувствительности подтверждены результаты анализа первой линии.
- В плане безопасности данный препарат был сопоставим с плацебо при наличии тенденции к уменьшению смертности (ОР 0,83). В целом препарат демонстрирует благоприятное соотношение «польза-риск».
Таким образом, предлагаемые в настоящее время основополагающие принципы и ранней, и отсроченной во времени реабилитации позволяют заметно снижать степень инвалидизации, повышать качество последующей жизни пациентов, способствовать более быстрому возвращению пациента к личной, бытовой, социальной и профессиональной активности. Важную роль в развитии этого подхода играет и современная медикаментозная нейрореабилитация, выстроенная на принципах доказательной медицины. При этом, как подчеркивают эксперты, успешность всех реабилитационных методик обеспечивается комплексным подходом, с учетом индивидуальных физических, эмоциональных, двигательных и когнитивных возможностей постинсультного пациента.
Ключевые слова: инсульт, реабилитация после инсульта, австрийские рекомендации по реабилитации больных после инсульта, нейропептиды, нейропротекция.
Литература
1 Пирадов М.А., Максимова М.Ю., Танашян М.М. Инсульт. Пошаговая инструкция. М. Гэлтар-Медиа, 2019, 272 с.
2 Wein T., Lindsay M.P., Cote R. et al. Canadian stroke best practice recommendations: Secondary prevention of stroke, sixth edition practice guidelines, update 2017. Int J Stroke. 2018, 13 (4), p. 420–443.
3 World Stroke Campaign. https://www.worldstrokecampaign.org/images/global_stroke_bill_of_rights/English_GlobalBO-Rights_web.pdf (zuletzt abgerufen 16.3.2018) 2018.
4 Powers W.J. et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2018, Mar., 49 (3), e46-e110. doi: 10.1161/STR.0000000000000158.
5 https://neurologic.ru/nejroreabilitacija-posle-insulta/
6 United Nations Organisation. https://www.un.org/development/desa/disabilities/convention-on-the-rights-of-persons-with-disabilities/article-26-habilitation-and- rehabilitation.html. 2018.
7 Neuhaus A.A., Couch Y., Hadley G., Buchan A.M. Neuroprotection in stroke: the importance of collaboration and reproducibility. Brain 2017, 140 (8), p. 2079–2092.
8 Pollock A., Baer G., Campbell P. et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database Syst Rev. 2014, (4):CD001920.
9 World Health Organisation. https://www.who.int/classifications/icf/en/ (zuletzt abgerufen 16.3.2018) 2018.
10 Одинак М.М., Вознюк И.А., Янишевский С.Н. Ишемия мозга. Нейропротективная терапия. Дифференцированный подход. СПб. ВМедА, 2002, 77 с.
11 Завалишин И.А., Захарова М.Н. Оксидантный стресс – общий механизм повреждения при заболеваниях нервной системы. Журнал неврологии и психиатрии. Т. 96, № 2, 1996, с. 111–114.
12 Scheidtmann K., Fries W., Muller F., Koenig E. Effect of levodopa in combination with physiotherapy on functional motor recovery after stroke: a prospective, randomised, double-blind study. Lancet. 2001, 358 (9284), p. 787–90.
13 Bornstein N.M., Guekht A., Vester J. et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol Sci. 2018, 39(4), p. 629–640.
14 Muresanu D.F., Heiss W.D., Hoemberg V. et al. Cerebrolysin and recovery after stroke (CARS): a randomized, placebo-controlled, double-blind, multicenter trial. Stroke. 2016, 47, p. 151–159.
15 Guekht A., Vester J., Heiss W.D. et al. Safety and efficacy of Cerebrolysin in motor function recovery after stroke: a meta-analysis of the CARS trials. Neurol Sci. 2017, 38, p. 1761–1769.
16 Windisch M., Gschanes A., Hutter–Paier B. Neurotrophic activities and therapeutic experience with brain derived peptide preparation. J. Neural. Transm. 1998, vol. 53, p. 289–298.
17 Windisch M., Albrecht E., Eggenreich U., Paier B. Neurotrophic effects of the nootropic drug cerebrolysin – a summary. 3rd Int. Conf. on Alzheimer’s disease and related disorders. Padova. 1992, p. 4–5.
18 Watanabe Y., Gould E., McEwen B.S. Stress-induced atrophy of apical dendrites of hippocampal CA3 pyramidal neurons. Brain Res. 1992, vol. 588, p. 341–345.
19 Востриков В.В., Шишляников Г.З., Зеленцов К.Е., Востриков М.В., Шабанов П.Д. Церебролизин в практической медицине. Обзоры по клинической фармакологии и лекарственной терапии. Т. 7, № 4, 2009, с. 21–75.
20 Читаева Г.Е., Никифорова А.Н., Сапон Н.А. Общепринятые и новые аспекты применения препарата церебролизин. Український нейрохірургічний журнал. 2005, №3, с. 123–131.
21 Ladurner G., Kalvach P., Gmeinbauer R. et al. The MCA stroke trial: A multicentre, randomized, double-blind, placebo-controlled trial of cerebrolysin in patients with ischaemic stroke. Neuroprotection in ischaemic stroke. 26-th Intern. stroke conf. of Amer. Heart As soc. 2001.
22 Коппи С., Баролин Г. Применение церебролизина в терапии ишемического инсульта. Журнал неврологии и психиатрии. Т. 98, № 10, 1998, с. 30–33.
23 Скворцова В.И. Ишемический инсульт: патогенез ишемии, терапевтические подходы. Неврологический журнал. Т. 6, № 3, 2001, с. 4–9.
24 Скворцова В.И. Нейропротективная терапия ишемического инсульта. Врач. № 6, 2004, с. 26–32.
25 Гусев Е.И., Гехт А.Б., Гаптов В.Б., Тихопой Е.В. Реабилитация в неврологии. М. 2000, 52 с.
26 Bornstein Natan M., Guekht Alla, Vester Johannes, Heiss Wolf-Dieter, Gusev Eugene et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurological Sciences. April 2018, vol. 39, iss.4, p. 629–640.
Источник
