Двойная дезагрегантная терапия после инфаркта миокарда
В статье рассматривается роль ацетилсалициловой кислоты во вторичной профилактике сердечно-сосудистых заболеваний, в частности ишемической болезни сердца и инфаркта миокарда.
Введение
Сердечно-сосудистые заболевания (ССЗ) остаются важнейшей причиной смертности повсеместно. По данным ВОЗ, в мире более 17 млн человек ежегодно умирают от ССЗ [1]. По заключению центров, контролирующих заболеваемость и ее профилактику (Centers for Disease Control and Prevention), средняя продолжительность жизни населения ожидаемо была бы на 10 лет больше при отсутствии возрастающе высокой распространенности ССЗ, охватывающей все страны и континенты. ССЗ приводят к инвалидизации взрослого населения и требуют колоссальных экономических затрат. Не случайно в литературе их называют эпидемией XXI века [1].
Улучшение качества диагностики и лечения не привело к ожидаемому снижению летальности от ССЗ во всем мире. Ишемическая болезнь сердца (ИБС) составляет львиную долю всех ССЗ. ИБС и ее осложнения продолжают лидировать среди причин смерти в экономически развитых странах, несмотря на значительный прогресс в контроле факторов риска и лечении, включая широкое распространение хирургических и эндоваскулярных методов реваскуляризации. Распространенность ИБС в нашей стране составляет 13,5%, в США — почти в 2 раза ниже, 7% [2, 3]. По данным P. Heidenreich et al. (2011), к 2030 г. распространенность ИБС увеличится на 9,3%, а прямые медицинские затраты возрастут на 198% по сравнению с таковыми в 2010 г. [3]. Ожидается, что к 2030 г. от ССЗ, в частности от ИБС и инсульта, умрут около 23,6 млн человек. По прогнозам, эти болезни останутся основными отдельными причинами смерти населения [4].
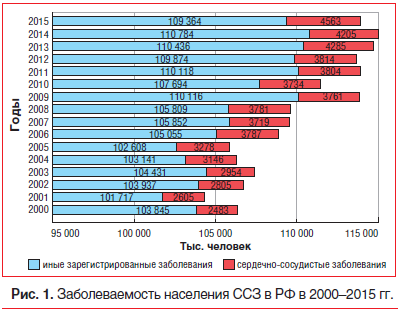
Все вышеуказанное в полной мере относится и к нашей стране. Доля болезней системы кровообращения в общей структуре смертности в Российской Федерации (РФ) составляет более 56%. По данным Министерства здравоохранения РФ и по расчетам Федеральной службы государственной статистики РФ, в период с 2000 по 2015 г. число заболевших ССЗ в России увеличилось в 1,8 раза (рис. 1) [5].
В период с 2000 по 2006 г. наблюдалась тенденция увеличения числа заболевших ССЗ, с 2007 по 2012 г. численность заболевших была близка к постоянной, с 2013 г. численность заболевших снова начала увеличиваться. В 2000 г. доля пациентов, заболевших ССЗ, от общего числа пациентов, заболевших другими заболеваниями, составляла 2,34%, в 2015 г. — 4,01% [5].
Стоит обратить внимание, что доля случаев преждевременной смерти от ССЗ варьирует от 4% в странах с высоким уровнем дохода населения до 42% в странах с низким уровнем дохода, что приводит к растущему неравенству между странами и группами населения по частоте возникновения ССЗ и их смертельных исходов.
Почему количество ССЗ растет в странах с низким и средним уровнем дохода?
Несколько фактов, дающих ответ на наш вопрос:
примерно в 75% случаев смерти от ССЗ в мире происходит в странах с низким и средним уровнем дохода;
население стран с низким и средним уровнем дохода часто не может пользоваться программами по оказанию комплексной первичной медико-санитарной помощи для раннего выявления и лечения лиц с факторами риска ССЗ, в отличие от населения в странах с высоким уровнем дохода, и в результате многие люди умирают от ССЗ и других неинфекционных заболеваний в молодом возрасте, в продуктивные годы жизни;
особенно страдает самая малообеспеченная часть населения в странах с низким и средним уровнем дохода. Имеется достаточно фактических данных, свидетельствующих, что ССЗ и другие неинфекционные заболевания способствуют дальнейшему обнищанию семей из-за катастрофических расходов на медицинскую помощь и высокой доли расходов из собственных средств;
на макроэкономическом уровне ССЗ накладывают тяжелое бремя на экономику стран с низким и средним уровнем дохода [1].
Каким образом можно уменьшить бремя ССЗ?
В качестве мер профилактики ССЗ и борьбы с ними ВОЗ определила ряд «наиболее выгодных» или высокоэффективных с точки зрения затрат мероприятий, которые возможно осуществить даже в условиях низкой обеспеченности ресурсами. Рассматриваются два вида мероприятий: касающиеся всего населения и индивидуальные, они могут использоваться в сочетании друг с другом для снижения высокого бремени ССЗ.
Меры, необходимые для снижения распространенности ССЗ на общенациональном уровне:
всесторонняя политика борьбы против табака;
налогообложение в целях снижения потребления продуктов с высоким содержанием жиров, сахара и соли;
строительство пешеходных и велосипедных дорожек для повышения уровня физической активности;
стратегии, направленные на снижение потребления алкоголя;
обеспечение правильного питания детей в школах [1].
Итак, ССЗ, и в частности ИБС, остаются главной причиной смертности и инвалидизации населения, что вызывает необходимость совершенствования лечебно-профилактических мероприятий по снижению распространенности ССЗ. Понимание причин развития этих заболеваний, а также расширение возможностей в области их профилактики, диагностики и лечения — один из ключевых приоритетов сегодняшней кардиологии [1, 2].
Специалисты понимают, что большинство сердечно-сосудистых событий можно предотвратить путем принятия адекватных мер по отношению к таким факторам риска, как употребление табака, нездоровое питание и ожирение, отсутствие физической активности и потребление алкоголя, с помощью стратегий, охватывающих все население.
Люди, страдающие ССЗ или имеющие высокий риск таких заболеваний (повышенное артериальное давление, диабет, гиперлипидемия), нуждаются в раннем выявлении и оказании помощи путем консультирования и, при необходимости, приема лекарственных средств.
Профилактика первых и повторных инфарктов миокарда (ИМ), инсультов в виде индивидуальных медико-санитарных мер должна быть направлена на лиц со средним или высоким уровнем общего сердечно-сосудистого риска или тех, у кого выявлены отдельные факторы риска (диабет, гипертония и гиперхолестеринемия) [6].
Общенаправленные меры (комплексный подход с учетом всех факторов риска) более эффективны с точки зрения затрат, чем индивидуальные, и они способны значительно снизить частоту случаев сердечно-сосудистых нарушений. Этот подход практически осуществим в условиях низкой обеспеченности ресурсами, включая использование неврачебного медицинского персонала [4].
Роль ацетилсалициловой кислоты во вторичной профилактике ССЗ
Для вторичной профилактики ССЗ лицам с уже имеющимся заболеванием, включая диабет, необходимо использовать следующие лекарственные средства:
ацетилсалициловая кислота (АСК);
бета-блокаторы;
ингибиторы ангиотензинпревращающего фермента;
статины.
Полученные положительные результаты в основном не связаны друг с другом, однако, если вторичную профилактику сочетать с прекращением курения, можно предотвратить почти 75% повторных сосудистых нарушений. В настоящее время имеются значительные недостатки в осуществлении этих мер, особенно на уровне первичной медико-санитарной помощи.
Основные меры по профилактике ИМ и смерти при ИБС в основном направлены на снижение частоты возникновения острых тромботических событий. Эта цель достигается путем фармакологической коррекции и изменения образа жизни. В основном для профилактики ССЗ назначают АСК в целях снижения агрегации тромбоцитов и предотвращения тромбообразования. Если вспомнить патофизиологию развития ССЗ, то роль АСК выходит на одну из первых позиций в лечении (рис. 2) [7].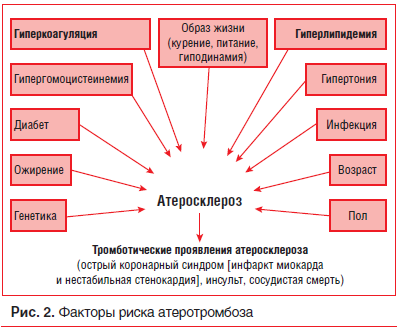
При развитии ССЗ наблюдается нарушение реологических свойств крови, в основе которого лежит изменение агрегации тромбоцитов и эритроцитов. В настоящее время ключевым моментом, определяющим выраженность нарушений кровоснабжения органов и тканей (сердца, головного мозга, периферических сосудов), считается активация тромбоцитов.
В этой связи дезагрегационная терапия является патогенетически обоснованной и важной составляющей в лечении большого числа широко распространенных заболеваний (различные формы ИБС, атеросклероз, нарушение мозгового кровообращения, сахарный диабет) и профилактике повторных осложнений, риск которых многократно возрастает после первого эпизода тромбоза (табл. 1).
На сегодняшний день АСК остается краеугольным камнем в фармакологической коррекции артериального тромбоза [6].
Механизм действия АСК (Сановаск®) хорошо изучен. Она ингибирует циклооксигеназу тромбоцитов и эндотелия сосудов, принимающую участие в метаболизме арахидоновой кислоты при образовании тромбоксана А2 (агрегант тромбоцитов и вазоконстриктор) (ТА2) и простациклина (дезагрегант и вазодилататор). АСК ингибирует агрегацию тромбоцитов и образование тромба в сосудах через блокаду синтеза ТА2 в тромбоцитах из арахидоновой кислоты. Наряду с этим механизмом АСК обладает еще и другими уникальными свойствами, выгодно отличающими ее от иных дезагрегантов: способностью подавлять образование фибрина, а также активировать фибринолиз за счет высвобождения активаторов плазминогена и «разрыхления» волокон фибрина [8].
Доказательная база эффективности АСК
Доказательная база по применению ацетилсалициловой кислоты (АСК) в настоящее время является одной из наиболее обширных и мощных [2]. Согласно европейским рекомендациям по лечению острого инфаркта миокарда (ОИМ) и стабильной ИБС считается, что большинству больных с ИБС следует принимать АСК пожизненно [4, 6]. По данным ряда метаанализов (боле 50 исследований), у 100 тыс. пациентов применение АСК с целью вторичной профилактики привело к снижению сердечно-сосудистой смертности примерно на 15% и частоты несмертельных сосудистых осложнений на 30%. Исследования VA, RISC, ISIS-2 доказали способность АСК снижать риск развития ОИМ и острой коронарной смерти на 41–70%. Сегодня правомерно утверждение, что АСК в дозах 75–325 мг/сут значительно снижает частоту случаев развития ИМ и внезапной смерти у больных с острым коронарным синдромом.
В исследовании Physicians’ Health Study (Исследование здоровья врачей) АСК в дозе 325 мг через день значительно снижала риск первого ИМ при наличии стабильной стенокардии [9]. Аналогично исследование Swedish Angina Pectoris Aspirin Trial (Исследование применения АСК при стенокардии в Швеции) продемонстрировало, что добавление 75 мг АСК к соталолу у 2035 пациентов со стабильной стенокардией снижало частоту первичных конечных точек (ИМ, внезапная смерть) на 34% и вторичных сердечно-сосудистых событий на 32% [10].
Анализ базы данных американских страховых компаний за период с января 2008 г. по июнь 2014 г. (n=103 787) подтвердил эффективность АСК в первичной профилактике ССЗ. Прием АСК снижал риск ИМ, инсульта и смерти от ССЗ на 11% (относительный риск (ОР) 0,89, 95% доверительный интервал (ДИ) 0,84–0,95) [11]. Сотрудничество исследователей антитромбоцитарных препаратов (Antiplatelet Trialists’ Collaboration) провело метаанализ данных 12 исследований (18 788 больных, перенесших ИМ), который показал, что антитромбоцитарная терапия (АСК в подавляющем большинстве) в среднем на протяжении 27 мес. значительно снижала частоту возникновения основных сердечно-сосудистых событий по сравнению с контролем [10].
Какие есть вопросы в назначении АСК на сегодняшний день?
В последнее время специалисты все чаще стали обращаться к двум проблемам, касающимся применения АСК.
Первая проблема — это резистентность к терапии АСК, так называемая аспиринорезистентность (АР, общепринятого термина на сегодняшний день нет). АР возможно определить как лабораторный или клинический феномен [12]. «Лабораторная резистентность» к антитромбоцитарным лекарствам — недостаточный эффект блокирования остаточной реактивности тромбоцитов (в частности, ассоциированной с продуцируемым ТА2), несмотря на использование антитромбоцитарных лекарств (т. е. пациент комплаентен) [5]. Клиническая же резистентность обусловлена развитием атеротромботических событий на фоне приема АСК (здесь можно применить понятие «клинический неуспех терапии АСК») [12]. Частота встречаемости АР варьирует от 2% до 43%, и связано это в первую очередь с отсутствием общепринятой методики оценки указанного состояния, широкой вариабельностью и малой воспроизводимостью результатов. Считается, что АР ассоциирована с ухудшением клинического прогноза заболевания. Так, данные исследований HOPE и CHARISMA продемонстрировали, что более высокие уровни 11-дегидро-тромбоксана В2 в моче (метаболита ТА2 и потенциального биомаркера нечувствительности к АСК) соответствовали повышенному риску развития сердечно-сосудистых катастроф. В метаанализе данных 2930 пациентов с ССЗ выявлено повышение ОР развития сосудистых осложнений (ОР 2,95, 95% ДИ 3,08–4,80), смерти (ОР 5,99, 95% ДИ 2,28–15,72) и острого коронарного синдрома (ОР 4,06, 95% ДИ 2,96–5,56) у больных, являвшихся, по результатам исследований, нечувствительными к АСК (табл. 2) [12].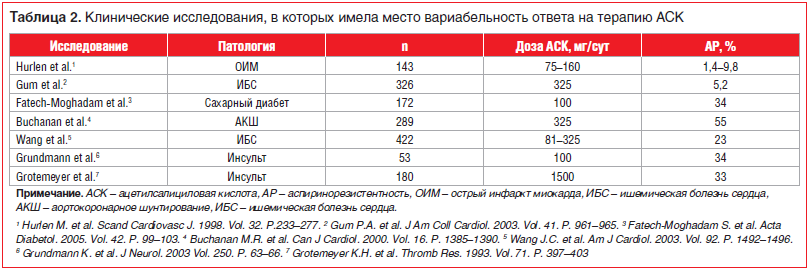
При этом стоит отметить, что наиболее частая причина развития АР — низкая комплаентность относительно АСК. Так, было показано, что 29% пациентов после ИМ имели АР, но 57% из них принимали АСК нерегулярно. Более того, только 60% пациентов, которым была назначена АСК, принимали ее [13].
Вторая проблема — АСК повышает риск кровотечения, в особенности у пожилых пациентов, развития диспептических расстройств и эрозивно-язвенного гастрита. Все чаще в структуре осложнений на фоне приема АСК наблюдаются скрытые и явные кровотечения, перфорации, стриктуры тонкого и толстого кишечника, обострения хронических энтероколитов. Наиболее часто в условиях реальной клинической практики решением вышеназванных проблем становится перевод пациента с АСК на другие дезагреганты, однако при этом в жертву приносится превосходство АСК по доказанности эффекта. В настоящее время доказано, что польза терапии АСК значительно превышает риск желудочно-кишечных кровотечений, что дает основание для применения АСК в ходе первичной и вторичной профилактики ССЗ [4, 6, 13, 14].
Учитывая вышесказанное, становится понятным приоритет назначения так называемых улучшенных форм АСК, прежде всего кишечнорастворимых, а также с контролируемым высвобождением, локальных (накожных), буферных с антацидами и др.
Преимущество таких «улучшенных форм», как минимум, заключается в их лучшей переносимости, что, в свою очередь, ведет к уменьшению случаев отказа от приема препарата и повышению приверженности длительному лечению [14].
Данные по эффективности и безопасности АСК как антитромбоцитарного препарата были получены в крупных рандомизированных контролируемых исследованиях при использовании обычной лекарственной формы. Однако на сегодняшний день имеется достаточное количество сведений, показывающих не только эффективность, но и безопасность кишечнорастворимых форм АСК по сравнению со всеми другими «улучшенными формами» [14].
По данным эндоскопических исследований (оценка безопасности различных форм АСК, включая обычную), отмечалась достоверно более низкая частота развития эрозивно-язвенных поражений желудочно-кишечного тракта при применении именно кишечнорастворимых форм АСК. Примером такого препарата являются таблетки, покрытые кишечнорастворимой пленочной оболочкой — Сановаск® (продукт компании ОАО «Авексима»).
Заключение
За долгое время существования фармакологии только два препарата, которые являются одновременно высокоэффективными и доступными (АСК и нитроглицерин), сохранили свои лидирующие позиции на протяжении многих десятилетий и по праву входят в современные стандарты и протоколы лечения многих заболеваний сердечно-сосудистой системы. Согласно международным рекомендациям и рекомендациям Всероссийского общества кардиологов [4, 6], назначение АСК при отсутствии противопоказаний целесообразно всем больным с высоким риском сердечно-сосудистых осложнений. К категории риска относят пациентов с острыми коронарными синдромами, стабильной стенокардией, атеросклеротическим поражением артерий нижних конечностей. Назначение АСК снижает частоту ИМ и инсультов (как повторных, так и первичных), риска тромбоэмболических осложнений и смертности от сердечно-сосудистых причин.
Источник
На последней научной сессии Американской коллегии кардиологов (ACC 2015), которая проходила 14-16 марта 2015г. в г.Сан-Диего, были представлены результаты нового анализа, выполненного по материалам исследования Двойная антиагрегантная терапия (Dual Antiplatelet Therapy, DAPT), которое ранее было доложено на прошлогодней научной конференции Американской кардиологической ассоциации (AHA) и в целом показало преимущество более длительной двойной антиагрегантной терапии (ДАТ). Новый анализ показал, что продление ДАТ до 30 месяцев по сравнению с ее прекращением через 1 год снижало риск тромбоза стента и инфаркта миокарда (ИМ) независимо от того, выполнялось ли исходное стентирование по поводу острого коронарного синдрома, или стабильной стенокардии. Ценой преимущества продленной ДАТ с точки зрения риска ишемических событий было повышение риска легких и умеренных кровотечений. Одновременно с представлением на ACC 2015 данный анализ был опубликован в журнале Journal of the American College of Cardiology.
В исследовании DAPT сравнивались 12 месяцев и 30 месяцев лечения тиенопиридинами (клопидогрел или прасугрел) в добавление к аспирину после стентирования коронарных артерий. Примерно две трети участников получали клопидогрел, а одна треть принимала прасугрел. Пациентов с ишемическими или геморрагическими осложнениями в течение первых 12 месяцев исключали из второго этапа (1230 месяц) исследования. Первичными конечными точками исследования были тромбоз стента и основные нежелательные сердечно-сосудистые и церебро-васкулярные нежелательные явления (комбинация из случаев смерти, ИМ или инсульта). Первичной конечной точкой безопасности было умеренное или тяжелое кровотечение по классификации GUSTO.
Авторы обсуждаемого подгруппового анализа выдвинули гипотезу о том, что пациенты с исходным ИМ могли извлечь больше пользы от продолжения ДАТ, поскольку у них был больше риск тромбоза стента и последующего ИМ, чем у участников с исходно стабильной ИБС. Исходный ИМ был в общей сложности у 3576 пациентов (30,7% от всей популяции исследования); они были рандомизированы в группы тиенопиридинов или плацебо на фоне аспирина. Аналогичным образом, на такие же группы были рандомизированы 8072 пациентов без исходного ИМ.
Пациенты с исходным ИМ были моложе (средний возраст 57,8 лет против 62,9 лет), среди них было больше мужчин и актуальных курильщиков и меньше лиц с сахарным диабетом 2 типа или артериальной гипертонией. Около половины случаев ИМ представляли собой ИМ без подъема сегмента ST (53%), а остальные 46,9% перенесли ИМ с элевацией сегмента ST.
Большинству пациентов (86%) были имплантированы стенты с лекарственным покрытием с сиролимумом (Cypher), зотаролимусом (Endeavor), паклитакселом (Taxus) или эверолимусом (Xience или Promus), а оставшиеся 14% получили непокрытые стенты. В среднем на одного пациента приходилось 1,5 стента.
Относительное снижение частоты тромбоза стента при продолжении приема клопидогрела или прасугрела было сходным, независимо от того, был ли поводом для исходного стентирования ИМ или стабильная стенокардия, однако у пациентов с исходным ИМ более длительная двойная антиагрегантная терапия ассоциировалась с большей степенью снижения частоты основных ишемических нежелательных явлений. Продолжение приема тиенопиридинов ассоциировалось со снижением частоты ИМ, но увеличением числа кровотечений.
Конечные точки в период с 12 до 30 месяцев после имплантации стента
Конечные точки в зависимости от исходных проявлений
Группа ДАТ (%)
Группа плацебо (%)
ОР (95% ДИ)
P
Тромбоз стента
ИМ
0,5
1,9
0,27(0,13–0,57)
0,001
Без ИМ
0,4
1,1
0,33 (0,18– 0,60)
0,001
Основные ишемические нежелательные явления
ИМ
3,9
6,8
0,56 (0,42–0,76)
0,001
Без ИМ
4,4
5,3
0,83 (0,68– 1,02)
0,08
Умеренное или тяжелое кровотечение по GUSTO
ИМ
1,9
0,8
2,38 (1,27– 4,43)
0,005
Без ИМ
2,6
1,7
1,53 (1,12– 2,08)
0,007
Инфаркт миокарда
ИМ
2,2
5,2
0,42 (0,29– 0,62)
0,001
Без ИМ
2,1
3,5
0,60 (0,45– 0,79)
0,001
Смерть
ИМ
1,4
1,6
0,87 (0,50– 1,50)
0,61
Без ИМ
2,1
1,5
1,43 (1,02–2,00)
0,04
Таким образом, у пациентов с исходным ИМ продление приема тиенопиридинов на дополнительные 18 месяцев ассоциировалось с абсолютным снижением риска инфаркта миокарда на 2,9% и риска тромбоза стента на 1,4% при абсолютном повышении риска умеренных и тяжелых кровотечений на 1,1%.
Поскольку в прочих исследованиях было показано, что ишемические осложнения в большей степени влияют на качество жизни, чем легкие и умеренные кровотечения, авторы анализа считают, что у пациентов, которым стентирование выполнялось по поводу острого ИМ и которые успешно перенесли ДАТ в течение года, имеются достаточно веские основания для ее дальнейшего продления. То же касается и тех пациентов, кому стентирование проведено не по экстренным показаниям. Полученная польза была, по видимому, равноценной у тех участников, которые получали клопидогрел или прасугрел, а также после имплантации покрытых паклитакселом стентов или остальных стентов.
Источник.
Источник
