Для обезболивания инфарктов миокарда

Снятие боли при развитии инфаркта или ее существенное уменьшение – это один из факторов благоприятного восстановления сердечной мышцы и предотвращения осложнений. Для обезболивания назначают сильнодействующие препараты из групп опиатов, нейролептиков, транквилизаторов. В качестве ингаляционного метода применяется закись азота, для введения в спинномозговой канал используют местные анестетики.
Зачем нужны анальгетики при инфаркте
Помимо непосредственного устранения болевого синдрома, введение анальгетиков снижает проявления стрессовой реакции в ответ на повреждение сердечной мышцы.
Доказано, что чем больше длится боль при инфаркте миокарда, тем интенсивнее образование и поступление в кровь таких соединений, как адреналин, норадреналин, дофамин, угнетающих коронарный кровоток. Болевой синдром высокой интенсивности приводит к частому развитию осложнений инфаркта.
Поэтому снятие боли является первоочередной задачей врачебной помощи. Введение обезболивающих начинается на этапе оказания первой врачебной помощи и продолжается на протяжении всего курса интенсивной терапии.
Основные группы препаратов, которые применяются для аналгезии:
- опиаты (Морфин, Промедол, Фентанил);
- анальгетики центрального действия (Трамадол, Налбуфин);
- нейролептики (Дроперидол);
- транквилизаторы (Диазепам);
- закись азота;
- местные анестетики (Лидокаин, Тримекаин).
Рекомендуем прочитать статью о лечении инфаркта миокарда в стационаре. Из нее вы узнаете об оказании неотложной помощи при инфаркте, лечении болевого синдрома в стационарных условиях.
А здесь подробнее о боли при инфаркте миокарда.
Наркотические анальгетики
Самыми мощными обезболивающими препаратами являются наркотические. Они быстро снимают боль, но ослабляют дыхание, снижают давление, силу сердечных сокращений, приводят к прогрессированию сердечной недостаточности. Поэтому применяют антагонисты опиатных рецепторов и специфические антидоты при развитии побочных реакций.
Опиоидные
Наиболее известный опиоидный анальгетик при инфаркте миокарда – это морфина гидрохлорид. Его вводят в вену, мышцу или под кожу. Начало действия наступает на протяжении 20 — 40 минут, полное обезболивание отмечается только у трети пациентов. Способен подавлять дыхательную функцию легких, работу пищеварительной системы, выделение мочи, вызывать рвотный рефлекс.
Промедол близок по клинической эффективности к Морфину, но имеет меньшее отрицательное влияние на дыхательный и рвотный центр, блуждающий нерв. Фентанил сильнее морфина почти в 100 раз, его действие наступает «на острие иглы», но продолжается не более получаса. Большие дозы нарушают дыхание, замедляют ритм сердечных сокращений.
Обезболивающие центрального действия
Фортрал – это блокатор опиатных рецепторов головного мозга. Он способен снизить угнетающий эффект Фентанила на дыхание, при этом не ослабив его обезболивающего действия. Длительность аналгезии примерно равна 3 часам.
Хорошие результаты получены при введении Трамадола и Налбуфина, они в достаточной степени снижают интенсивность болевого синдрома, но при этом не ослабляют деятельность дыхательной и сердечно-сосудистой системы, менее опасны для пожилых пациентов.
Показаны при наличии:
- умеренной боли в сердце,
- недостаточности кровообращения,
- противопоказаний к наркотическим анальгетикам.
При значительном угнетении дыхания, спазме коронарных сосудов или снижении сократительной способности миокарда, вызванных наркотическими анальгетиками, вводится Налоксон. Он снимает эти побочные эффекты, но одновременно ослабляет и их обезболивающее действие.
Обезболивание нейролептиками при инфаркте
Совместное применение нейролептиков и анальгетиков помогает затормозить не только центральную нервную систему, но и восстановить нормальные гормональные реакции организма, устранить вегетативный дисбаланс.
Такая комбинация способствует:
- понижению чувствительности к боли;
- наступлению двигательного покоя;
- снятию психического возбуждения;
- предотвращению шокового состояния;
- ликвидации тошноты и рвоты.
В качестве анальгетика можно использовать: Фентанил, Трамадол, Анальгин, Спазмалгон, Баралгин. Их действие возрастает при предварительном введении Гепарина. Нейролептиком чаще всего бывает Дроперидол.
Для больных после 60 лет рекомендуется увеличить процентное содержание ненаркотического компонента для профилактики дыхательной недостаточности.
Атаралгезия – комбинация анальгетика и транквилизатора
Это сочетание дает примерно такое же обезболивающее действие, как и нейролептаналгезия, но меньше нарушает дыхание, внутрисердечное и системное кровообращение. Атаралгезию назначают больным с серьезными заболеваниями внутренних органов, особенно она показана пациентам старческого возраста.
Метод помогает:
- снизить периферическое сопротивление сосудов, а, следовательно, и нагрузку на сердце;
- ускорить наступление анальгезирующего эффекта и продлить его действие;
- замедлить распространение болевых импульсов, понизить к ним восприимчивость.
Анальгетики выбирают из наркотической или ненаркотической подгруппы (аналогично смесям для нейролептаналгезии), а транквилизатором обычно бывает Диазепам, Реланиум.
Смотрите на видео об инфаркте миокарда, оказании помощи и лечении:
Закись азота при инфаркте
Это средство имеет выраженное обезболивающее действие при содержании в воздушной смеси от 40%, при более высоких дозах возможна потеря сознания. Закись азота почти не раздражает бронхи, не приводит к мышечной слабости, через 10 минут выводится через дыхательные пути.
Традиционно ингаляции кислородно-азотной смеси используют для снятия болевого синдрома у больных с инфарктом сердечной мышцы. Имеются данные о сужении просвета артерий сердца, расположенных под внешней оболочкой, а также снижении сократительной функции миокарда в ходе лечения, поэтому рекомендуется только кратковременное использование закиси азота.
Эпидуральная блокада
Для лечения приступа сердечной боли, который не снимается анальгетиками, введенными в достаточно больших дозах, проводится блокада корешков спинного мозга. Для этого применяют местно анестезирующие средства и наркотические анальгетики.
Действие на сердце
Методика спинномозговой блокады называется фармакологической денервацией сердечной мышцы. После наступления обезболивания проявляются следующие эффекты:
- расширяются артерии и более мелкие сосуды (артериолы, капилляры);
- расслабляются стенки вен с депонированием в них крови;
- снижается венозный возврат к сердцу и периферическое сопротивление сосудов, а значит, пред- и постнагрузка на сердце;
- нормализуется ударный объем;
- замедляется сердечный ритм;
- понижается давление в артериях, правой и левой половине сердца, легочных сосудах;
- проводимость миокарда не изменяется;
- потребность в кислороде уменьшается;
- восстанавливается оксигенация артериальной крови;
- кровь становится более жидкой за счет активизации обменных процессов на уровне капилляров.
Препараты
Чаще всего для блокады используют 2% раствор Лидокаина или Тримекаина. Обезболивание наступает через 5 минут. У пациентов отмечается быстрое обратное развитие ишемии сердечной мышцы.
К недостаткам относится риск травмирования спинного мозга и развитие аллергических реакций.
Перспективным методом считается введение в полость спинномозгового канала минимальных доз Морфина или Фентанила. Они позволяют снять боль на протяжении суток без риска нежелательных эффектов. Отмечено даже положительное влияние на газообмен, кровообращение, восстановление вегетативного баланса, улучшение ЭКГ на фоне их применения.
Показания и противопоказания
Эпидуральная анестезия назначается в следующих ситуациях:
- сильная боль в сердце, на которую не действуют наркотические анальгетики;
- рецидивы инфаркта или затяжное течение;
- угроза разрыва сердечной мышцы;
- перикардит или аневризма сердца.
Запрещается проводить введение препаратов в спинномозговой канал при наличии:
- активной воспалительной реакции в месте пункции;
- сепсиса;
- кардиогенного шока;
- непереносимости препаратов для блокады;
- заболеваний позвоночника, периферической или центральной нервной системы.
Адекватное обезболивание у пациентов с инфарктом сердечной мышцы помогает улучшить самочувствие и снизить вероятность развития осложнений. Для ликвидации болевого синдрома используют наркотические анальгетики как наиболее мощные средства. Из-за угнетающего влияния на дыхательный и сосудодвигательный центр их комбинируют с ненаркотическими средствами, заменяют антагонистами опиатных рецепторов.
Также могут быть назначены сочетания анальгетиков и транквилизаторов или нейролептиков. Ингаляционное введение закиси азота в смеси с кислородом показано для кратковременного применения. Спинномозговая блокада является методом выбора при неэффективности опиатов и других методов анальгезии.
Источник
Обезболивание при инфаркте миокарда. Купирование боли при инфаркте миокарда.Адекватное и быстрое обезболивание при инфаркте миокарда (первоочередная проблема) должно проводиться еще на догоспитальном этапе. Оно помогает разорвать порочный круг (ишемия миокарда -> боль -> ишемия миокарда), снизить активность симпатической нервной системы (уменьшить работу миокарда), ослабить рефлекторные влияния из очага поражения на тонус периферических сосудов и сердечный выброс (предотвратить формирование рефлекторного КШ). Подход к купированию боли состоит из двух этапов: уменьшения ишемии миокарда и непосредственного влияния на боль. Антиишемическая терапия включает реинфузию, назначение р-АБ, нитратов, ингаляции кислорода. Больному нельзя давать половинные дозы анальгетиков, он не должен терпеть боль – это угроза его жизни. Важный аспект обезболивания — снижение ПО2 миокардом (на фоне строгого постельного режима, нормализации ЧСС и АД). Оптимальный путь обезболивания — устранение причины боли, т.е. восстановление коронарного кровотока (тромболизис). Для купирования боли в отсутствие гипотонии сразу используют не более 3 раз сублингвальный прием нитроглицерина (в домашних условиях, если нет возможности ввести парентерально обезболивающие), потом его назначают внутривенно капельно. Если боль не купируется, то обычно вводят внутривенно наркотические ЛС (но не внутримышечно или подкожно, ибо в этом случае анальгезирующий эффект слаб и наступает поздно). При болевом синдроме на фоне возбуждения и повышения АД наркотические ЛС назначают сразу. Они уменьшают ишемию миокарда, страх и тахикардию. Наркотики купируют боль не только прямо, но и опосредованно за счет снижения тонуса САС, что уменьшает П02 миокардом. В качестве дополнительных мер (когда внутривенное введение опиатов оказалось недостаточно эффективным) назначают внутривенно АБ и нитраты.
Купирование боли при инфаркте миокарда включает следующее. САД должно не снижаться менее 100 мм рт. ст. или уменьшаться на 15% от исходного у больных с нормальным АД (на 30% у гипертоников). Нитроглицерин полезен в лечении ИМ, осложненного ОСН в случае сохранения симптоматики или повышения АД. Вместо нитроглицерина можно использовать изокет (внутривенно капельно 50 мг в 100 мл изотонического раствора со скоростью вливания 8—10 капель в минуту под контролем АД). Нитраты не назначают больным с САД менее 90 мм рт. ст., ЧСС менее 50 уд/мин или более 110 уд/мин и подозрением на ИМ ПЖ. После внутривенного введения нитратов больным с СН или сохраняющейся ишемией назначают их орально с большими временными интервалами, чтобы избежать тахифилаксии. Нитраты нормализуют коронарный кровоток, особенно в ишемизированной зоне, и уменьшают боль (за счет снижения ПО2 миокардом вследствие возникновения периферической вазодилатаиии), зону некроза, напряжение и объем желудочков, ремоделирование миокарда в пораженной зоне и частоту механических осложнений. Но надо иметь в виду, что нитраты купируют ангинозную боль, тогда как при ИМ превалирует боль от околонекрозных участков, поэтому здесь лучше использовать наркотические ЛС. • Назначение оксигенотерапии (100% увлажненный кислород) позволяет повысить диффузию кислорода в ишемизированный миокард. Она должна проводиться каждому больному через носовой катетер в первые 6 ч, а при появлении признаков застоя в легких, ОЛ или КШ — через маску или интубационную трубку. • АБ показаны всем больным (при отсутствии противопоказаний) в первые 4—12 ч инфаркта миокарда независимо от проведения тромболизиса при гипердинамических состояниях (тахиаритмиях, повышении АД), повторно возникающих ангинозных приступах, не «отпускающих» после введения наркотических ЛС, прогрессирующем росте кардиоспецифических ферментов (что указывает на расширение зоны ИМ). Р-АБ снижают симпатическое влияние на миокард, ЧСС и ПО2 миокардом (этим сохраняют его жизнеспособность), вероятность повторной ишемии (и нового ИМ), зону некроза миокарда (при раннем назначении), боль, потребность в анальгетиках и появление опасных аритмий. Для быстрого эффекта Р-АБ назначают сначала в малой дозе внутривенно болюсом метопролол по 5 мг через каждые 5—10 мин, 3 болюса — под контролем ЭКГ и АД (ориентиры — целевая ЧСС 50—60 уд/мин, САД 100 мм рт. ст. и более) и потом внутрь (обычно при сохранении стабильной гемодинамики после 3-й дозы) по 50 мг через каждые 6 ч в течение 2 дней, а позднее – по 100 мг 2 раза в сутки; альтернатива — внутрь пропранолол (по 50 мг через каждые 6 ч; поддерживающая доза — 50—200 мг/сут) или атенолол (внутривенно 2 болюса по 5 мг с интервалом в 5 мин, потом поддерживающая доза — 100 мг/сут). У больных с пограничными параметрами гемодинамики лечение начинают с небольших доз АБ (метопролол 12,5—25 мг 2 раза в сутки). Орально АБ должны использоваться в лечении ИМ как можно раньше, независимо от параллельного проведения ПЧКА или тромболизиса. Р-АБ должны назначаться в период клинических проявлений ИМ до тех пор, пока не появятся «специфические» осложнения (слабость ЛЖ, брадикардия). Эти ЛС уменьшают ударный объем сердца, который при ИМ уже заметно снижен. Они противопоказаны при ОСН (влажные хрипы выше 10 см над диафрагмой); тяжелой ХСН с малой ФВЛЖ; гипотонии (САД менее 90 мм рт. ст.); брадикардии (ЧСС менее 60 уд/мин); прогрессирующей АВ-блокаде II степени (или PQ более 0,24 с); бронхоспастическом синдроме (даже в анамнезе); выраженной патологии периферических артерий, инсулинзависимом СД. Следует избегать назначения АБ у больных с неясной тахикардией, так как это может вызвать декомпенсацию имеющейся СН у больных с компенсаторной тахикардией. – Также рекомендуем “Тактика при интенсивных болях инфаркта миокарда. Восстановление перфузии ишемизированной зоны миокарда.” Оглавление темы “Диагностика и лечение инфаркта миокарда.”: |
Источник
М.М. Ожегова, В.К. Ожегов
Новогрудское ТМО, кардиологическое отделение – ОАРИТ
В 1996 году сердечная патология была ответственна за большее число смертей,
чем цереброваскулярные нарушения, рак легкого, рак молочной железы и СПИД вместе
взятые [Ventura SJ, Peters KD, Martin JA, et al. Births and decaths: United
States, 1996. Mon Vital Siat Rep 1997, 46 (1 Suppl 2): 1-40].
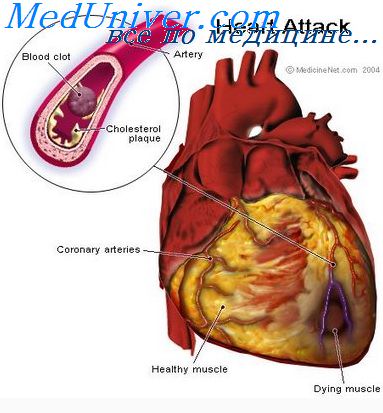
Острый коронарный синдром включает целый спектр сердечных приступов – от
нестабильной стенокардии до инфаркта миокарда.
В основе лежит окклюзии просвета одной из эпикардиальных коронарных артерий
тромбом. Последнее приводит к некрозу кровоснабжаемого артерией участка
сердечной мышцы вследствие несоответствия притока кислорода и субстратов
метаболизма к миокарду и потребностью в них [Л.И. Ольбинская, П.Ф. Литвицкий.
Коронарная и миокардиальная недостаточность. М., Медицина,1986]. Объем некроза
зависит в первую очередь от длительности и стойкости прекращения тока крови по
сосуду (хотя значение имеют и некоторые другие факторы – наличие и выраженность
коллатерального кровообращения, потребность миокарда в кислороде в момент
окклюзии и т.д.).
Механизм развития боли принято объяснять следующим образом.
На ранних этапах гипоксии и ишемии миокарда значительно уменьшается
содержание калия в кардиомиоцитах в связи с выходом его из клетки в межклеточное
пространство. Кроме того, в миокарде начинает преобладать анаэробный гликолиз,
вследствие чего накапливаются молочная кислота, водородные ионы, развивается
ацидоз. Эти процессы сопровождаются накоплением в миокарде таких биологически
активных веществ, как аденозин, брадикинин, гистамин, серотонин, нейропептид Р.
Эти вещества вызывают раздражение рецепторов миокарда и окончаний симпатического
и блуждающего нервов. Импульсы от чувствительных окончаний внутрисердечных
нервов достигают сердечного сплетения и затем передаются к симпатическим
ганглиям, расположенным на уровне C7-Th4.
Далее импульсы передаются в
гипоталамус и кору головного мозга – основные высшие центры, активация которых
формирует ощущение боли. Нейропептид Р значительно облегчает передачу боли в
высшие воспринимающие центры. Интенсивность боли зависит также от уровня
содержания в ЦНС эндогенных опиатов – эндорфинов и энкефалинов и, как следствие,
функционального состояния опиоидергической системы мозга [А.Н.Окороков.
Диагностика болезней внутренних органов. т.6. М. Медицинская литература, 2002.].
Проблема обезболивания – одна из важнейших при лечении ОКС. Конечный
результат интенсивной терапии во многом зависит от эффективности аналгезии [Альперт
Д., Френсис Г. Лечение инфаркта миокарда (пер. с англ.). М., Практика, 1994.;
Бабкин А.П., Усков В.М., Владыкина Н.Н. Новое в диагностике, лечении. / Сборник
научных трудов. Воронеж. 1991. С.24-26.]. Чем выраженнее и продолжительнее
болевой синдром, тем больше опасность развития тяжелых осложнений [Рябов Г.А.
Синдромы критических состояний. М., Медицина, 1994.; Сумин С.А. Неотложные
состояния. Москва, “Литера”, 1997.]. Главной задачей обезболивания является
смягчение стрессорной реакции при минимальном угнетающем действии медикаментов
на системы кровообращения и дыхания. Снижение или полное купирование болевого
стресса способствуют уменьшению числа осложнений и более благоприятному течению
заболевания [Kaul S., Abbot R.D. Annals of Intensive Medicine. 1994. Vol. 121.
P. 967-968.]. В настоящее время для купирования болевого синдрома у больных ИМ
используется большое количество лекарственных средств с различными механизмами
действия [Храмов В.В., Чаплинский С.В., Сушарин Л.Н., Лемехов П.Г. Тезисы
докладов и сообщений 6-го Всероссийского съезда анестезиологов и реаниматологов,
Москва, 1998. С.249.].
Опиоидные (наркотические) аналгетики (НА)
Термином “опиаты” обычно обозначают вещества, извлекаемые из опия: морфин,
кодеин, а также полусинтетические соединения, которые получают на основе
указанных алкалоидов или тебаина, также содержащегося в опии.
Опиоидами называют
все вещества естественного и синтетического происхождения, взаимодействующие с
опиоидными рецепторами и имеющими сходство с морфином по фармакологическим
свойствам [Goodman and Gilman’s the Pharmacological Basic of Therapeutics/ –
9-th Ed./ Eds-in-chief J.G. Hardman, L.E. Limbird. – 1996.].
Фармакологические эффекты опиоидных аналгетиков обусловлены их
взаимодействием с опиоидными рецепторами в ЦНС и периферических тканях. Морфин,
фентанил, алфентанил, суфентанил и др. составляют группу агонистов опиоидных
рецепторов, проявляя наибольшее сродство к μ-рецепторам. Бупренорфин, буторфанол,
налбуфин, пентазоцин относятся к группе частичных агонистов и
агонистов-антагонистов опиоидных рецепторов. Различные эффекты опиоидных
аналгетиков связывают с возбуждением разных подтипов опиоидных рецепторов [В.В.
Чурюканов. Болеутоляющие средства: Сравнительная оценка, механизмы действия,
перспективы. //Анест. и реаниматол.- 1998.-№5.-С4-11.].
Морфина гидрохлорид является основным представителем группы НА. Обладает
мощной аналгетической активностью, вызывает чувство эйфории, устраняет тревогу и
страх, вызывает дилатацию периферических артерий и вен (“бескровную флеботомию”),
но угнетает дыхание и усиливает активность рвотного центра. Бесспорным
достоинством препарата является уменьшение гемодинамической нагрузки на сердце
за счёт снижения пред- и постнагрузки [В.В.Руксин. Неотложная кардиология.
Санкт-Петербург. Невский диалект. 2000.]. Используется внутривенно в дозе 3-5
мг, при необходимости и отсутствии нарушений дыхания или других побочных
эффектов, повторно вводят по3-5мг морфина до суммарной дозы 10 мг; внутримышечно
или подкожно – 10-20 мг. Наибольший обезболивающий эффект развивается в
зависимости от способа введения через 30-60 минут. Полного обезболивания обычно
удается достичь в 15-30% случаев, неполного – в 40-60%.
Другим НА, часто используемым для обезболивания ИМ, является промедол.
Препарат по своим свойствам близок к морфину, но меньше угнетает дыхательный
центр, меньше возбуждает рвотный центр и центр блуждающего нерва.
Разовая доза
при внутривенном и внутримышечном введении у больных ИМ составляет 10-20 мг.
Наиболее популярным НА является фентанил [Яикин Ю.М., Плотникова Н.Д.,
Гольберг Г.А. Догоспитальный этап острого инфаркта миокарда. / Под ред. Р.С.
Карпова. Томск, Изд. Томского университета, 1993.]. Это синтетический НА, с
выраженным аналгетическим действием (в 100 раз превосходит морфин). При
внутривенном введении препарата в дозе 0,05-0,1 мг (1-2 мл 0,005% раствора)
эффект наступает через 1-3 минуты и продолжается в течение 15-30 минут [Сыркин
А.Л. Инфаркт миокарда. М., Медицина. 1998.]. Характеризуется коротким периодом
действия (около 30 минут). При внутривенном введении в дозе 0,1-0,5 мг может
вызвать резкое угнетение дыхания, ригидность грудной клетки, брадикардию.
В последние годы для обезболивания ИМ используются пентазоцин, налбуфин,
трамадол [Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. М., АИР-АРТ,
1998.]. Пентазоцин (фортрал) является слабым антагонистом опиатов.
Способен снимать угнетающее действие на дыхание фентанила, сохраняя аналгезию.
Длительность аналгезии при введении препарата в дозе 30 мг в среднем составляет
3-4 часа. Увеличение дозы более 30 мг обычно не влечёт большее угнетение
дыхания, однако при этом возрастает частота возникновения дисфории и других
психомиметических эффектов. В отличие от морфина пентазоцин может вызывать
повышение артериального давления и тахикардию, что ограничивает применение
препарата при ИМ [В.В. Чурюканов. Болеутоляющие средства: Сравнительная оценка,
механизмы действия, перспективы. //Анест. и реаниматол.- 1998.-№5.-С4-11.].
Налбуфин (нубаин) является аналгетиком синтетическою ряда. По
фармакодинамике схож с пентазоцином. В отличие от последнего мало влияет на
сердечно-сосудистую систему, не оказывает гипердинамического действия на
кровообращение [В.С. Литовченко, А.В. Блинов. Применение морадола и нубаина для
купирования болевого синдрома у больных ИБС. //Анест. и реаниматол.-
1998.-№5.-С.30-31.].
Обезболивающий эффект после внутривенного введения 10-20 мг
наступает через 3-5 минут, после внутримышечного – через 5-10 минут.
Длительность эффекта – 4-6 часов. Препарат вводится, в среднем, 3-4 раза в сутки
[Литовченко B.C. Тезисы докладов и сообщений 6-го Всероссийского съезда
анестезиологов и реаниматологов. / Москва, 1998. С.156.]. Хорошие результаты
обезболивания ИМ отмечаются при использовании трамадола в средней дозе
1,4 мг/кг (достигнуто достаточное обезболивание в 58,8% случаев) [Лебедева Р.Н.,
Никода В.В. Фармакотерапия острой боли. М., АИР-АРТ, 1998.]. Препарат более
безопасен по сравнению с морфином и промедолом, мало угнетает дыхание,
существенно не влияет на желудочно-кишечный тракт, обладает значительно меньшим
наркогенным потенциалом, поэтому его более целесообразно использовать у больных
пожилого возраста с умеренным болевым синдромом или с сердечной недостаточностью
[В.В. Чурюканов. Болеутоляющие средства: Сравнительная оценка, механизмы
действия, перспективы. //Анест. и реаниматол.- 1998.-№5.-С4-11.].
Нейролептаналгезия (НЛА)
При купировании болевого синдрома у больных ИМ необходимо блокировать не
только центральные, но и клеточные, эндокринные и вегетативные реакции организма
на повреждающие воздействия [Мажерова О.П., Олесин А.И. Прогнозирование и
лечение жизненно угрожающих осложнений острого инфаркта миокарда на
догоспитальном этапе и в клинике. / Метод, рекомендации. Л., ЛНИИС, 1991.]. Эта
задача может быть решена с помощью НЛА – сочетанного применения аналгетика и
нейролептика. НЛА оказывает селективное воздействие на клетки зрительного бугра,
подбугорной области, ретикулярную формацию, вызывая потерю болевой
чувствительности, состояние психического и двигательного покоя без наступления
сна. В качестве нейролептика обычно используется дроперидол [Сыркин А.Л.
Инфаркт миокарда. М., Медицина. 1998.]. Препарат вызывает выраженное
нейровегетативное торможение, оказывает противошоковый эффект, обладает
противорвотным действием [Малая Л.Т.
Неосложненные и осложненные формы
заживления инфаркта миокарда. Киев, Здоровье, 1992.], Аналгетическим компонентом
чаще всего служит фентанил, но может использоваться другой препарат (трамадол,
ненаркотические аналгетики). Существует готовая смесь – таламонал,
которая содержит 0,05 мг фентанила и 2,5 мг дроперидола в 1 мл. Обезболивающий
эффект НЛА можно усилить предварительным введением 10-15 тыс. ЕД гепарина
[Голиков А.П. Сб. статей, посвященных 75-летию со дня основания Станции скорой и
неотложной медицинской помощи города Москвы. 1994. С. 19-22.].
НЛА обеспечивает хорошее обезболивание у большинства больных. У больных
пожилого и старческого возраста с выраженной сопутствующей соматической
патологией при использовании классической НЛА выявляются нарушения функции
внешнего дыхания [Дзизинский А.А., Тумак В.Н., Бидагаев В.Б. Анестезиология и
реаниматология, 1990. N5. С. 43-45.; Закин А.М. Нейролептанальгезия в остром
периоде инфаркта миокарда под контролем функции дыхания. Автореф. дис. канд.
мед. наук. М., 1979.]. Чтобы при проведении НЛА избежать угнетения дыхания,
целесообразно усиливать ненаркотический компонент (анальгин, баралгин, трамадол
и т.п.) [Яикин Ю.М., Плотникова Н.Д., Гольберг Г.А. Догоспитальный этап острого
инфаркта миокарда. / Под ред. Р.С. Карпова. Томск, Изд. Томского университета,
1993.].
Атаралгезия.
Атаралгезией называют метод комбинированного использования транквилизаторов и
НА (например, 2 мл 0,005% раствора фентанила и 2 мл 0,5% раствора диазепама)
[Сумин С.А. Неотложные состояния. Москва, “Литера”, 1997.]. Клиника атаралгезии
сходна с клиникой нейролептаналгезии, но характеризуется меньшими нарушениями
дыхания и гемодинамики, что позволяет широко использовать данную методику у
больных пожилого и старческого возраста с выраженной сопутствующей патологией
[Сумароков А.В., Моисеев B.C. Клиническая кардиология. / Руководство для врачей.
М., 1995. С. 38.]. Наибольшее применение для атаралгезии из транквилизаторов
получил диазепам [Руксин В.В.
Основы неотложной кардиологии. Л., АООТ “Эвеланш”.
1994.; Провоторов В.М., Усков В.М., Барташевич Б.И. Инфаркт миокарда. Воронеж,
1999.]. Препарат не оказывает прямого влияния на миокард, но кратковременно
уменьшает общее периферическое сопротивление, благодаря чему может несколько
снижаться артериальное давление и сердечный выброс. Препарат параллельно с
торможением поведенческих проявлений ноцицептивных реакций значительно уменьшает
прессорные реакции артериального давления и тахикардию, усиливает
кардиохронотропный эффект барорефлекса и модулирующую функцию “аналгетических”
систем среднего мозга. В качестве аналгетика чаще всего используются фентанил,
промедол, пентазоцин в обычных или несколько уменьшенных дозировках (возможно
использование других препаратов) [Кузнецова О.Ю., Михайлович В.А., Руксин В.В.
Болевой синдром / Под редакцией В.А. Михайловича, Ю.Д. Игнатова. Л.: Медицина,
1990. С. 189-205.].
Клонидин.
Клонидин – водорастворимый препарат, легко проникающий через
гематоэнцефалический барьер. Обладает селективными α-2-адреностимулирующими
свойствами. Имеющиеся данные позволяют рекомендовать препарат для включения в
комплекс аналгетических средств, используемых при болевом синдроме у больных с
инфарктом миокарда [Кузнецова О.Ю., Михайлович В.А., Руксин В.В. Болевой синдром
/ Под редакцией В.А. Михайловича, Ю.Д. Игнатова. Л.: Медицина, 1990. С. 189-205
.]. Помимо обезболивающего эффекта клонидин способен обеспечивать уменьшение
работы поврежденного миокарда путем уменьшения адренергических воздействий на
сердце. Использование препарата показано у больных с артериальной гипер- и
нормотензией. Его применение ограничено при наличии артериальной гипотензии. По
мнению В.А. Михайловича и соавт., клонидин, обладающий одновременно
аналгетическим и гемодинамическим свойствами, может занять промежуточную позицию
междусобственно аналгетическими препаратами и специфическими способами
лечения ИМ, в основе действия которых лежит уменьшение нагрузки на миокард.
Средства для ингаляционного наркоза.
Наиболее широко для обезболивания у больных ИМ использовалась закись азота
[Сыркин А.Л. Инфаркт миокарда. М., Медицина. 1998.]. Аналгезирующее действие
закиси наступает при концентрации 35-45 об.%. Утрата сознания наблюдается при
концентрации, равной 60-80%, но не у всех пациентов. Закись азота обладает
достаточным аналгетическим эффектом при купировании болевого синдрома у
большинства пациентов с ИМ. В концентрациях до 80% она практически безвредна для
организма. Использование более высоких концентраций ведет к развитию гипоксии.
Хотя закись азота принято считать одним из традиционных способов обезболивания
при ИМ, в настоящее время имеется ряд публикаций, заставляющих более осторожно
подходить к ее использованию. Выявлено, что закись азота способна вызывать
сужение эпикардиальных коронарных артерий и усугублять повреждение сердечной
мышцы с последующим уменьшением насосной функции сердца [Trekova N., Kojevnicova
V., Flerov E. Book of abstracts, 8th European congress of anesthesiology. /
Warsaw, 1990. 4/6.1 -3.].
Другие средства для ингаляционного наркоза (пентран, трилен и др.) в
настоящее время используются редко для проведения обезболивания у больных ИМ или
применяются по определенным показаниям (необходимость выключения сознания при
кардиоверсии, выполнении болезненных манипуляций, проведении искусственной
вентиляции легких и т.п.) [Провоторов В.М., Усков В.М., Барташевич Б.И. Инфаркт
миокарда. Воронеж, 1999.]. Это обусловлено необходимостью использования
специальной наркозной аппаратуры и специфическими особенностями препаратов
(способность сенсибилизации миокарда и т.п.) [Кузнецова О.Ю., Михайлович В.А.,
Руксин В.В. Болевой синдром / Под редакцией В.А. Михайловича, Ю.Д. Игнатова. Л.:
Медицина, 1990. С. 189-205.].
Электрообезболивание.
Транскраниальная электроаналгезия представляет собой воздействие
электрическим током на структуры головного мозга, которое способно вызывать
состояние обезболивания или снижать интенсивность болевых ощущений [Лебедев В.П.
Болевой синдром. / Под редакцией Михайловича В.А., Игнатова Ю.Д. Л., Медицина.
1990. С. 162-172.]. Механизм возникновения аналгезии при электростимуляционных
способах обезболивания связан с активацией эндогенных опиатных структур. Это
приводит к высвобождению опиоидных пептидов, в частности, β-эндорфина,
концентрация которого в плазме и спинномозговой жидкости возрастает в несколько
раз. Кроме того, стимуляция толстых периферических афферентных волокон угнетает
интернейроны головного мозга и не позволяет болевым импульсам, проводящимся по
тонким А-cигма и С-волокнам, достигать центральной нервной системы.
Рекомендуемые параметры: частота 1000-2000 Гц, длительность импульсов –
0,15-0,20 мсек, величина среднего тока – от 0,1 до 3,0 мА. Длительность
процедуры электрообезболивания составляет 40-60 минут 1 раз в день в первые трое
суток заболевания. Аналгетическое действие развивается не сразу, а через 10-15
минут [Провоторов В.М., Усков В.М., Барташевич Б.И. Инфаркт миокарда. Воронеж,
1999.]. Эффект одной процедуры сопровождается длительным аналгетическим
последействием (2-24 часа).
Транскраниальная электроаналгезия позволяет получить достаточный уровень
обезболивания у большинства больных ИМ (купирующий эффект 84,3%) [Руксин В.В.
Основы неотложной кардиологии. Л., АООТ “Эвеланш”. 1994.]. При этом отмечается
нормализация артериального давления, частоты сердечных сокращений и дыхания.
Методика достаточна эффективна и безопасна, практически нe имеет
противопоказаний.
Параллельно с купированием болевого синдрома проводятся все остальные
лечебно-диагностические мероприятия:
Восстановление коронарного кровотока. Уменьшение работы сердца и потребности миокарда в кислороде. Ограничение размеров инфаркта миокарда. Лечение и профилактика осложнений инфаркта миокарда.
Источник
