Дезагреганты при инфаркте миокарда
Антикоагулянтная терапия при инфаркте миокарда. Антиаггрегантная терапия при инфаркте миокарда.Гепарин назначают при инфаркте миокарда любого типа — больным с повышением сегмента ST и без такового в следующих случаях: на ЭКГ нет зубца Q; депрессия сегмента ST; высокий риск тромботических осложнений (для их профилактики); предупреждение новой окклюзии коронарной артерии; для повышения эффективности ТЛТ; реинфаркт; ХСН; фибрилляция предсердий (ФП) и тромбоз глубоких вен голеней. Больной, которому тромболизис не проводился, должен получать внутривенно НФГ с первых часов инфаркта миокарда болюсом 60 ЕД/кг (максимально 4000 ЕД), потом со скоростью 12 ЕД/кгч (максимальная доза — 1000 ЕД/ч) или лучше НМВГ, обладающие большей биодоступностью и более длительным эффектом (дальтепарин 100 МЕ/кг подкожно 2 раза в сутки или фрагмин 120 МЕ/кг подкожно 2 раза в сутки, или надропарин 86 МЕ/кг внутривенно болюсом, потом подкожно 86 МЕ/кг 2 раза в сутки), плюс аспирин в малой дозе (0,1 г/сут) для профилактики тромбоза глубоких вен голеней (в последующем — и ТЭЛА) и формирования тромбов в ЛЖ. НМВГ не используют у больных с ИМ с повышением интервала ST, в возрасте старше 75 лет и при патологии почек. Лечение гепарином проводят 5—8 дней. Он вводится подкожно (под контролем АЧТВ, оно не должно превышать 90 с), лучше в переднюю брюшную стенку, так как она — наиболее безопасное место для введения гепарина. Если вводить его в других областях, то имеется очень большой риск попадания в мышцу и развития массивных внутримышечных гематом. Терапия малыми дозами НФГ уменьшает агрегацию тромбоцитов. В последующем переходят на антиагрегантную терапию аспирином (в суточной дозе 100 мг). Больные передним обширным инфарктом миокарда (с тромбами в полости ЛЖ, верифицированными на ЭхоКГ) имеют высокий риск мозговых эмболии и должны получать гепаринотерапию минимум еще 3 недели после ИМ (целевое MHO 2,0—3,0). При необходимости проведения длительной антикоагулянтной терапии на амбулаторном этапе (невозможность приема аспирина, наличие внутрисердечного тромба и флеботромбоза, эпизод ФП длительностью более 48 ч) назначают варфарин под контролем MHO (целевое 2,0-4,0). Если у больного возникла возвратная ишемия (ранняя постинфарктная Ст в первые дни инфаркта миокарда) вследствие повторной закупорки коронарной артерии, то опять вводятся тромболитики. В целом назначение тромболитика с аспирином — «золотой стандарт» лечения ИМ с подъемом интервала ST. Учитывая недостаточно высокую эффективность тромболитической терапии (ТЛТ), в настоящее время широко используются интервенционные методы лечения инфаркта миокарда. Так, альтернативой ТЛТ является «спасательная» ПЧКА, которая лучше (в 90%), чем ТЛТ, восстанавливает коронарный кровоток и дает мало геморрагических осложнений. ПЧКА проводят (на фоне приема аспирина и внутривенного введения НФГ) для реперфузии пораженной зоны всем больным (любого возраста): со сроком ИМ менее 12 ч (или 24 ч при сохранении симптоматики) и с типичными изменениями ЭКГ; которым противопоказана ТЛТ или она оказалась неэффективной (через 90 мин после ТЛТ нет признаков восстановления реперфузии); при наличии опытного медицинского персонала и соответствующего оборудования. ПЧКА проводится с помощью раздувающегося баллончика, в котором катетером создается давление в 5 атм, бляшка разрушается и просвет пораженной артерии механически увеличивается (но обломки бляшки могут, двигаясь дистально по току крови, вызывать микроинфаркт). При необходимости в просвет пораженной артерии ставят стент («пружинку»). Если нельзя в течение 90 мин осуществить ПЧКА, делают тромболизис. Больные инфарктом миокарда с зубцом Q и мультисосудистым поражением коронарных артерий (или Kill) или те, у кого были неэффективными ТЛТ и/или ПЧКА в течение 6 ч от начала симптоматики, должны подвергаться АКШ. – Также рекомендуем “Улучшение кровообращения зон инфаркта. Нитраты при лечении инфаркта миокарда.” Оглавление темы “Принципы лечения инфаркта миокарда. Осложнения инфаркта миокарда.”: |
Источник
В статье рассматривается роль ацетилсалициловой кислоты во вторичной профилактике сердечно-сосудистых заболеваний, в частности ишемической болезни сердца и инфаркта миокарда.
Введение
Сердечно-сосудистые заболевания (ССЗ) остаются важнейшей причиной смертности повсеместно. По данным ВОЗ, в мире более 17 млн человек ежегодно умирают от ССЗ [1]. По заключению центров, контролирующих заболеваемость и ее профилактику (Centers for Disease Control and Prevention), средняя продолжительность жизни населения ожидаемо была бы на 10 лет больше при отсутствии возрастающе высокой распространенности ССЗ, охватывающей все страны и континенты. ССЗ приводят к инвалидизации взрослого населения и требуют колоссальных экономических затрат. Не случайно в литературе их называют эпидемией XXI века [1].
Улучшение качества диагностики и лечения не привело к ожидаемому снижению летальности от ССЗ во всем мире. Ишемическая болезнь сердца (ИБС) составляет львиную долю всех ССЗ. ИБС и ее осложнения продолжают лидировать среди причин смерти в экономически развитых странах, несмотря на значительный прогресс в контроле факторов риска и лечении, включая широкое распространение хирургических и эндоваскулярных методов реваскуляризации. Распространенность ИБС в нашей стране составляет 13,5%, в США — почти в 2 раза ниже, 7% [2, 3]. По данным P. Heidenreich et al. (2011), к 2030 г. распространенность ИБС увеличится на 9,3%, а прямые медицинские затраты возрастут на 198% по сравнению с таковыми в 2010 г. [3]. Ожидается, что к 2030 г. от ССЗ, в частности от ИБС и инсульта, умрут около 23,6 млн человек. По прогнозам, эти болезни останутся основными отдельными причинами смерти населения [4].
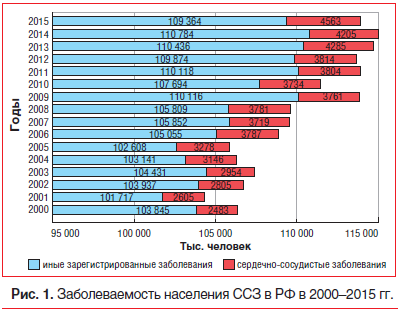
Все вышеуказанное в полной мере относится и к нашей стране. Доля болезней системы кровообращения в общей структуре смертности в Российской Федерации (РФ) составляет более 56%. По данным Министерства здравоохранения РФ и по расчетам Федеральной службы государственной статистики РФ, в период с 2000 по 2015 г. число заболевших ССЗ в России увеличилось в 1,8 раза (рис. 1) [5].
В период с 2000 по 2006 г. наблюдалась тенденция увеличения числа заболевших ССЗ, с 2007 по 2012 г. численность заболевших была близка к постоянной, с 2013 г. численность заболевших снова начала увеличиваться. В 2000 г. доля пациентов, заболевших ССЗ, от общего числа пациентов, заболевших другими заболеваниями, составляла 2,34%, в 2015 г. — 4,01% [5].
Стоит обратить внимание, что доля случаев преждевременной смерти от ССЗ варьирует от 4% в странах с высоким уровнем дохода населения до 42% в странах с низким уровнем дохода, что приводит к растущему неравенству между странами и группами населения по частоте возникновения ССЗ и их смертельных исходов.
Почему количество ССЗ растет в странах с низким и средним уровнем дохода?
Несколько фактов, дающих ответ на наш вопрос:
примерно в 75% случаев смерти от ССЗ в мире происходит в странах с низким и средним уровнем дохода;
население стран с низким и средним уровнем дохода часто не может пользоваться программами по оказанию комплексной первичной медико-санитарной помощи для раннего выявления и лечения лиц с факторами риска ССЗ, в отличие от населения в странах с высоким уровнем дохода, и в результате многие люди умирают от ССЗ и других неинфекционных заболеваний в молодом возрасте, в продуктивные годы жизни;
особенно страдает самая малообеспеченная часть населения в странах с низким и средним уровнем дохода. Имеется достаточно фактических данных, свидетельствующих, что ССЗ и другие неинфекционные заболевания способствуют дальнейшему обнищанию семей из-за катастрофических расходов на медицинскую помощь и высокой доли расходов из собственных средств;
на макроэкономическом уровне ССЗ накладывают тяжелое бремя на экономику стран с низким и средним уровнем дохода [1].
Каким образом можно уменьшить бремя ССЗ?
В качестве мер профилактики ССЗ и борьбы с ними ВОЗ определила ряд «наиболее выгодных» или высокоэффективных с точки зрения затрат мероприятий, которые возможно осуществить даже в условиях низкой обеспеченности ресурсами. Рассматриваются два вида мероприятий: касающиеся всего населения и индивидуальные, они могут использоваться в сочетании друг с другом для снижения высокого бремени ССЗ.
Меры, необходимые для снижения распространенности ССЗ на общенациональном уровне:
всесторонняя политика борьбы против табака;
налогообложение в целях снижения потребления продуктов с высоким содержанием жиров, сахара и соли;
строительство пешеходных и велосипедных дорожек для повышения уровня физической активности;
стратегии, направленные на снижение потребления алкоголя;
обеспечение правильного питания детей в школах [1].
Итак, ССЗ, и в частности ИБС, остаются главной причиной смертности и инвалидизации населения, что вызывает необходимость совершенствования лечебно-профилактических мероприятий по снижению распространенности ССЗ. Понимание причин развития этих заболеваний, а также расширение возможностей в области их профилактики, диагностики и лечения — один из ключевых приоритетов сегодняшней кардиологии [1, 2].
Специалисты понимают, что большинство сердечно-сосудистых событий можно предотвратить путем принятия адекватных мер по отношению к таким факторам риска, как употребление табака, нездоровое питание и ожирение, отсутствие физической активности и потребление алкоголя, с помощью стратегий, охватывающих все население.
Люди, страдающие ССЗ или имеющие высокий риск таких заболеваний (повышенное артериальное давление, диабет, гиперлипидемия), нуждаются в раннем выявлении и оказании помощи путем консультирования и, при необходимости, приема лекарственных средств.
Профилактика первых и повторных инфарктов миокарда (ИМ), инсультов в виде индивидуальных медико-санитарных мер должна быть направлена на лиц со средним или высоким уровнем общего сердечно-сосудистого риска или тех, у кого выявлены отдельные факторы риска (диабет, гипертония и гиперхолестеринемия) [6].
Общенаправленные меры (комплексный подход с учетом всех факторов риска) более эффективны с точки зрения затрат, чем индивидуальные, и они способны значительно снизить частоту случаев сердечно-сосудистых нарушений. Этот подход практически осуществим в условиях низкой обеспеченности ресурсами, включая использование неврачебного медицинского персонала [4].
Роль ацетилсалициловой кислоты во вторичной профилактике ССЗ
Для вторичной профилактики ССЗ лицам с уже имеющимся заболеванием, включая диабет, необходимо использовать следующие лекарственные средства:
ацетилсалициловая кислота (АСК);
бета-блокаторы;
ингибиторы ангиотензинпревращающего фермента;
статины.
Полученные положительные результаты в основном не связаны друг с другом, однако, если вторичную профилактику сочетать с прекращением курения, можно предотвратить почти 75% повторных сосудистых нарушений. В настоящее время имеются значительные недостатки в осуществлении этих мер, особенно на уровне первичной медико-санитарной помощи.
Основные меры по профилактике ИМ и смерти при ИБС в основном направлены на снижение частоты возникновения острых тромботических событий. Эта цель достигается путем фармакологической коррекции и изменения образа жизни. В основном для профилактики ССЗ назначают АСК в целях снижения агрегации тромбоцитов и предотвращения тромбообразования. Если вспомнить патофизиологию развития ССЗ, то роль АСК выходит на одну из первых позиций в лечении (рис. 2) [7].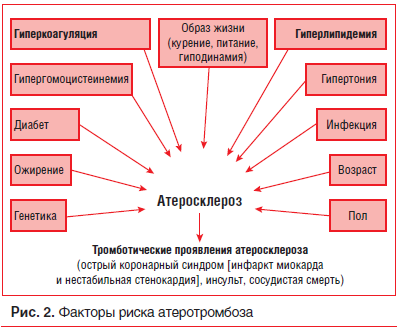
При развитии ССЗ наблюдается нарушение реологических свойств крови, в основе которого лежит изменение агрегации тромбоцитов и эритроцитов. В настоящее время ключевым моментом, определяющим выраженность нарушений кровоснабжения органов и тканей (сердца, головного мозга, периферических сосудов), считается активация тромбоцитов.
В этой связи дезагрегационная терапия является патогенетически обоснованной и важной составляющей в лечении большого числа широко распространенных заболеваний (различные формы ИБС, атеросклероз, нарушение мозгового кровообращения, сахарный диабет) и профилактике повторных осложнений, риск которых многократно возрастает после первого эпизода тромбоза (табл. 1).
На сегодняшний день АСК остается краеугольным камнем в фармакологической коррекции артериального тромбоза [6].
Механизм действия АСК (Сановаск®) хорошо изучен. Она ингибирует циклооксигеназу тромбоцитов и эндотелия сосудов, принимающую участие в метаболизме арахидоновой кислоты при образовании тромбоксана А2 (агрегант тромбоцитов и вазоконстриктор) (ТА2) и простациклина (дезагрегант и вазодилататор). АСК ингибирует агрегацию тромбоцитов и образование тромба в сосудах через блокаду синтеза ТА2 в тромбоцитах из арахидоновой кислоты. Наряду с этим механизмом АСК обладает еще и другими уникальными свойствами, выгодно отличающими ее от иных дезагрегантов: способностью подавлять образование фибрина, а также активировать фибринолиз за счет высвобождения активаторов плазминогена и «разрыхления» волокон фибрина [8].
Доказательная база эффективности АСК
Доказательная база по применению ацетилсалициловой кислоты (АСК) в настоящее время является одной из наиболее обширных и мощных [2]. Согласно европейским рекомендациям по лечению острого инфаркта миокарда (ОИМ) и стабильной ИБС считается, что большинству больных с ИБС следует принимать АСК пожизненно [4, 6]. По данным ряда метаанализов (боле 50 исследований), у 100 тыс. пациентов применение АСК с целью вторичной профилактики привело к снижению сердечно-сосудистой смертности примерно на 15% и частоты несмертельных сосудистых осложнений на 30%. Исследования VA, RISC, ISIS-2 доказали способность АСК снижать риск развития ОИМ и острой коронарной смерти на 41–70%. Сегодня правомерно утверждение, что АСК в дозах 75–325 мг/сут значительно снижает частоту случаев развития ИМ и внезапной смерти у больных с острым коронарным синдромом.
В исследовании Physicians’ Health Study (Исследование здоровья врачей) АСК в дозе 325 мг через день значительно снижала риск первого ИМ при наличии стабильной стенокардии [9]. Аналогично исследование Swedish Angina Pectoris Aspirin Trial (Исследование применения АСК при стенокардии в Швеции) продемонстрировало, что добавление 75 мг АСК к соталолу у 2035 пациентов со стабильной стенокардией снижало частоту первичных конечных точек (ИМ, внезапная смерть) на 34% и вторичных сердечно-сосудистых событий на 32% [10].
Анализ базы данных американских страховых компаний за период с января 2008 г. по июнь 2014 г. (n=103 787) подтвердил эффективность АСК в первичной профилактике ССЗ. Прием АСК снижал риск ИМ, инсульта и смерти от ССЗ на 11% (относительный риск (ОР) 0,89, 95% доверительный интервал (ДИ) 0,84–0,95) [11]. Сотрудничество исследователей антитромбоцитарных препаратов (Antiplatelet Trialists’ Collaboration) провело метаанализ данных 12 исследований (18 788 больных, перенесших ИМ), который показал, что антитромбоцитарная терапия (АСК в подавляющем большинстве) в среднем на протяжении 27 мес. значительно снижала частоту возникновения основных сердечно-сосудистых событий по сравнению с контролем [10].
Какие есть вопросы в назначении АСК на сегодняшний день?
В последнее время специалисты все чаще стали обращаться к двум проблемам, касающимся применения АСК.
Первая проблема — это резистентность к терапии АСК, так называемая аспиринорезистентность (АР, общепринятого термина на сегодняшний день нет). АР возможно определить как лабораторный или клинический феномен [12]. «Лабораторная резистентность» к антитромбоцитарным лекарствам — недостаточный эффект блокирования остаточной реактивности тромбоцитов (в частности, ассоциированной с продуцируемым ТА2), несмотря на использование антитромбоцитарных лекарств (т. е. пациент комплаентен) [5]. Клиническая же резистентность обусловлена развитием атеротромботических событий на фоне приема АСК (здесь можно применить понятие «клинический неуспех терапии АСК») [12]. Частота встречаемости АР варьирует от 2% до 43%, и связано это в первую очередь с отсутствием общепринятой методики оценки указанного состояния, широкой вариабельностью и малой воспроизводимостью результатов. Считается, что АР ассоциирована с ухудшением клинического прогноза заболевания. Так, данные исследований HOPE и CHARISMA продемонстрировали, что более высокие уровни 11-дегидро-тромбоксана В2 в моче (метаболита ТА2 и потенциального биомаркера нечувствительности к АСК) соответствовали повышенному риску развития сердечно-сосудистых катастроф. В метаанализе данных 2930 пациентов с ССЗ выявлено повышение ОР развития сосудистых осложнений (ОР 2,95, 95% ДИ 3,08–4,80), смерти (ОР 5,99, 95% ДИ 2,28–15,72) и острого коронарного синдрома (ОР 4,06, 95% ДИ 2,96–5,56) у больных, являвшихся, по результатам исследований, нечувствительными к АСК (табл. 2) [12].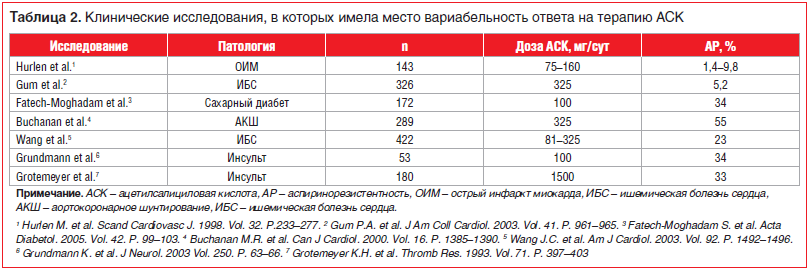
При этом стоит отметить, что наиболее частая причина развития АР — низкая комплаентность относительно АСК. Так, было показано, что 29% пациентов после ИМ имели АР, но 57% из них принимали АСК нерегулярно. Более того, только 60% пациентов, которым была назначена АСК, принимали ее [13].
Вторая проблема — АСК повышает риск кровотечения, в особенности у пожилых пациентов, развития диспептических расстройств и эрозивно-язвенного гастрита. Все чаще в структуре осложнений на фоне приема АСК наблюдаются скрытые и явные кровотечения, перфорации, стриктуры тонкого и толстого кишечника, обострения хронических энтероколитов. Наиболее часто в условиях реальной клинической практики решением вышеназванных проблем становится перевод пациента с АСК на другие дезагреганты, однако при этом в жертву приносится превосходство АСК по доказанности эффекта. В настоящее время доказано, что польза терапии АСК значительно превышает риск желудочно-кишечных кровотечений, что дает основание для применения АСК в ходе первичной и вторичной профилактики ССЗ [4, 6, 13, 14].
Учитывая вышесказанное, становится понятным приоритет назначения так называемых улучшенных форм АСК, прежде всего кишечнорастворимых, а также с контролируемым высвобождением, локальных (накожных), буферных с антацидами и др.
Преимущество таких «улучшенных форм», как минимум, заключается в их лучшей переносимости, что, в свою очередь, ведет к уменьшению случаев отказа от приема препарата и повышению приверженности длительному лечению [14].
Данные по эффективности и безопасности АСК как антитромбоцитарного препарата были получены в крупных рандомизированных контролируемых исследованиях при использовании обычной лекарственной формы. Однако на сегодняшний день имеется достаточное количество сведений, показывающих не только эффективность, но и безопасность кишечнорастворимых форм АСК по сравнению со всеми другими «улучшенными формами» [14].
По данным эндоскопических исследований (оценка безопасности различных форм АСК, включая обычную), отмечалась достоверно более низкая частота развития эрозивно-язвенных поражений желудочно-кишечного тракта при применении именно кишечнорастворимых форм АСК. Примером такого препарата являются таблетки, покрытые кишечнорастворимой пленочной оболочкой — Сановаск® (продукт компании ОАО «Авексима»).
Заключение
За долгое время существования фармакологии только два препарата, которые являются одновременно высокоэффективными и доступными (АСК и нитроглицерин), сохранили свои лидирующие позиции на протяжении многих десятилетий и по праву входят в современные стандарты и протоколы лечения многих заболеваний сердечно-сосудистой системы. Согласно международным рекомендациям и рекомендациям Всероссийского общества кардиологов [4, 6], назначение АСК при отсутствии противопоказаний целесообразно всем больным с высоким риском сердечно-сосудистых осложнений. К категории риска относят пациентов с острыми коронарными синдромами, стабильной стенокардией, атеросклеротическим поражением артерий нижних конечностей. Назначение АСК снижает частоту ИМ и инсультов (как повторных, так и первичных), риска тромбоэмболических осложнений и смертности от сердечно-сосудистых причин.
Источник
