Что такое пенумбра при инсульте

Пороги ишемии и пенумбра. Ишемический отек мозга
Пороги ишемии. Локальная или тотальная ишемия приводит к недостатку кислорода и глюкозы. Когда мозговая перфузия опускается ниже функционального порога (18—22 мл/1 00 г мозговой ткани в минуту), перестают регистрироваться вызванные потенциалы, а ЭЭГ становится плоской. Если перфузия вновь восстанавливается, функция мозга нормализуется (как по электрофизиологическим, так и по клиническим данным).
Если же перфузия опускается еще ниже и становится менее 8—1 0 мл/1 00 г мозговой ткани в минуту, наступает необратимое повреждение мозга; этот уровень называют порогом инфаркта.
Выраженность морфологических нарушений зависит не только от пороговых показателей кровотока, но и от продолжительности воздействия ишемии. Если перфузия поддерживается на уровне ниже функционал ьного порога достаточно длительное время, происходит гибель отдельных нейронов. Особенно чувствительны к ишемии, например, нейроны гиппокампа.
Ишемическая пенумбра. Зона головною мозга, показатели перфузии в которой находятся в промежутке между функциональным порогом и порогом инфаркта, называется «пенумбра». Как правило, инфаркт головного мозга с необратимо поврежденной мозговой тканью окружен такой зоной. Судьба вещества мозга в этой зоне зависит от времени и степени восстановления кровотока.
Состояние пенумбры можно исследовать с помошью методов функциональной нейровизуализации, например ПЭТ (позитронной эмиссионной томографии). Перфузнойная МРТ оценивает объем ткани мозга с пониженным кровотоком, а Диффузионная МРТ -ткани с необратимыми изменениями. Разница между этими двумя объемами (ткань мозга с нарушенной перфузией минус ткань мозга с патологической диффузией) позволяет приблизительно оценить размеры пенумбры и, соответственно, теоретически определить размеры участка мозга, который можно «спасти» с помощью терапии.
После наступления ишемии в качестве одного из основных ее осложнений развивается отек мозга. В соответствии с осмотическими закономерностями макромолекулы и электролиты, перемещаясь из внеклеточного пространства внугрь клетки, влекут за собой воду, которая из-за нарушения функции натрий-калиевого насоса не может быть транспортирована обратно.
Поэтому развивается клеточный (цитотоксичеекий) отек мозга, который можно выявить на диффузионно-взвешенных МРТ-изображениях. Если ишемия сохраняется длительное время и нарушается гематоэнцефапичсский барьер, составные части плазмы и с ними осмотически активные вещества начинают проникать во внеклеточное пространство, в связи с этим во внеклеточном пространстве также увеличивается содержание воды (вазогенный отек мозга). Позднее, при присоединении вазогенного компонента отека, свободная вода распространяется в белом веществе вдоль пучков нервных волокон.
В результате зона отека приобретает «пальце видные контуры», как в случае пазогенною отека мозга при опухолях. Выраженный are к может оказывать масс-эффект, приводя к локальному или диффузному повышению внутричерепного давления. Это может приводить к ухудшению перфузии пенумбры, расширению зоны инфаркта, и в конечном итоге к транстенториальному вклинению сверху вниз или снизу вверх (соответственно при супра- и инфратенториальных инфарктах).
– Также рекомендуем “Основы анатомии мозговых сосудов. Вертебрально-базилярная система”
Оглавление темы “Сосудистая патология головного мозга”:
1. Компьютерная томография при цереброваскулярных заболеваниях. Внутривенное контрастирование при КТ
2. Магнитно-резонансная томография. Методика МРТ головного мозга
3. Влияние кровотока на МРТ головного мозга. Перфузионная и диффузионная МРТ
4. Функциональная МРТ головного мозга. Показания к КТ и МРТ головного мозга
5. Ультразвуковое исследование мозговых сосудов. Допплеросонография
6. Цветная дуплексная ультрасонография. Техника дуплексной ультрасонографии
7. Эхокардиография. Ишемический инсульт
8. Пороги ишемии и пенумбра. Ишемический отек мозга
9. Основы анатомии мозговых сосудов. Вертебрально-базилярная система
10. Интра- и экстракраниальное коллатеральное кровообращение. Типы инсультов головного мозга
Источник
Мультимодальная визуализация головного мозга и сосудов в острейшем периоде ишемического инсульта, пожалуй, является “матерью всех споров” в современную эпоху борьбы с инсультом. Противоположные взгляды на этот вопрос достаточно устойчивы, и сторонники этих концепций зачастую ловко их защищают, как в случае с доктором P.D. Lyden и доктором M.W. Parsons. Давайте выделим следующие факты: (1) для ткани мозга критическим показателем является время — каждая минута на счету, (2) значение ишемической пенумбры как потенциально жизнеспособной ткани в случае своевременной и успешной реперфузии не подлежит сомнению. Теперь обратимся к следующим вопросам относительно потенциальной пользы (или ее отсутствия) получения дополнительных данных по результатам диффузионно-взвешенной МРТ, перфузионной МРТ или КТ, или КТ-ангиографии, МР-ангиографии или транскраниальной допплерографии.
Существуют ли дополнительные преимущества определения анатомии сосудов у пациента с инсультом, поступившего в течение установленного периода времени от момента появления симптомов, пригодного для введения тканевого активатора плазминогена (ТАП)? Безусловно, знание характера и локализации поражения сосудов до начала лечения полезно. Однако вряд ли оно окажет влияние на тактику ведения пациента в течение первых 3–4,5 часов от начала инсульта, независимо от локализации окклюзии артерии, поскольку не существует доказательств, свидетельствующих об эффективности эндоваскулярных вмешательств в качестве терапии первой линии в течение этого временнoго окна, особенно если учесть время, необходимое для получения результатов ангиографии даже в самых передовых центрах лечения больных инсультом [1]. Однако что делать, если при визуализации сосудов не выявляют окклюзии артерий? Необходимо ли начинать системный тромболизис? Доктор M.W. Parsons и другие эксперты утверждают, что эмболию дистальных отделов артерий трудно обнаружить при проведении визуализации сосудов и в этой ситуации более чувствительным методом является визуализация перфузии. Исходы заболевания у пациентов с “отрицательными” результатами визуализации сосудов, которым проводили системный тромболизис, были изучены недостаточно и в течение длительного времени зреет необходимость вдумчивого изучения этого вопроса. Итак, мы согласны с доктором P.D. Lyden, утверждающим, что пациентам с инсультом, поступившим в течение указанного временнoго окна и соответствующим всем критериям для проведения тромболизиса, необходимо без промедления внутривенно вводить ТАП, и что визуализацию сосудов необходимо выполнять только после начала проведения системного тромболизиса с целью определения характера и локализации окклюзии артерии, поскольку это может служить основанием для зачисления в текущие исследования вспомогательного системного тромболизиса и эндоваскулярных вмешательств.
А что насчет визуализации пенумбры и “несоответствия”? Перфузионная визуализация позволяет оценить ткань пенумбры на основе концепции “несоответствия”, хотя необходимо решить много вопросов, касающихся точности различных методов визуализации и пороговых значений, и провести стандартизацию оценочных показателей. Выявление “несоответствия” может быть потенциально полезным в 3 случаях: (1) удлинение временнoго интервала для лечения пациентов, которым в соответствии с современными стандартами проведение тромболитической терапии не показано; (2) рекомендация отказаться от проведения тромболизиса некоторым пациентам, поступающим в течение 3–4,5 часов в связи с его бесполезностью; (3) выявление кандидатов, не подходящих для проведения системного тромболизиса, которым показано проведение вспомогательных эндоваскулярных вмешательств. На сегодняшний день основное внимание было сфокусировано на использовании результатов перфузионной визуализации с целью продления срока начала реперфузионной терапии за пределы 3–4,5-часового временнoго окна, а доказательств, подтверждающих влияние проведения визуализации пенумбры на улучшение исходов после инсульта попросту нет. Использование “несоответствия” в качестве визуализационного критерия с целью улучшения отбора пациентов для проведения системного тромболизиса и других реперфузионных методов лечения, безусловно, рационально. Тем не менее ответ на лечение и клинические исходы являются сложными процессами, на которые оказывают влияние множество факторов, таких как размер и локализация инфаркта и пенумбры, состав тромба, исходная тяжесть инсульта, возраст, уровень содержания глюкозы в крови и т.д. Поэтому приравнивание простого наличия “несоответствия” к показанию либо ответу на проведение реперфузионной терапии не всегда целесообразно. Мы с нетерпением ждем результатов нескольких продолжающихся клинических испытаний, таких как Extending the Time for Thrombolysis in Emergency Neurological Deficits (EXTEND), MR and Recanalization of Stroke Clots Using Embolectomy (MRRESCUE), Desmoteplase in Acute Ischemic Stroke Trial-4 (DIAS-4) и Diffusion and Perfusion Imaging Evaluation for Understanding Stroke Evolution-2 (DEFUSE-2), чтобы определить, поможет ли визуализация пенумбры расширить временнoе окно за пределы 3–4,5 часов для проведения системного тромболизиса или другой реперфузионной терапии у пациентов с инсультом и привести к улучшению исходов заболевания. Опубликовано мало данных относительно использования концепции “несоответствия” в течение 3–4,5-часового окна. Перфузионная визуализация в течение этого времени может иметь потенциально важное клиническое значение. Данные испытаний DEFUSE и Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET), в которых изучали пациентов, поступивших в течение 3–6 часов от момента появления симптомов инсульта, показывают, что частота развития благоприятного исхода не зависит от статуса реперфузии у пациентов без “несоответствия”, подразумевая, что таким пациентам проводить реперфузионную терапию не следует. Тем не менее современные стандарты по лечению и страх перед судебно-медицинскими исками существенно ограничивают использование результатов перфузионной визуализации для индивидуализированного отбора пациентов на проведение тромболизиса в течение 3–4,5-часового временнoго окна. В настоящее время и до тех пор, пока рандомизированное клиническое испытание поддерживает использование перфузионной визуализации для эффективного отбора “хорошо” реагирующих на реперфузионную терапию пациентов, мы можем рекомендовать использование результатов перфузионной визуализации только в отдельных случаях у пациентов, которым в противном случае на основании существующих стандартов, проведение реперфузионной терапии не показано. Это относится к пациентам, поступившим спустя 3–4,5 часа от момента появления симптомов инсульта или с неизвестным временем начала инсульта. В течение 3–4,5-часового окна перфузионная визуализация может быть полезна в тех случаях, когда неизвестно, обусловлено ли развитие неврологического дефицита инсультом, судорожным припадком (паралич Тодда) [2] или метаболическими расстройствами, например гипогликемией, а также у пациентов, у которых после тщательного клинического обследования диагноз “инсульт” вызывает сомнения [3]. Кто-то может утверждать, что проведение системного тромболизиса “безопасно” при масках инсульта, мы согласны, но…разве это то, что нужно для практической медицины?
Мы пришли к выводу, что уравнительный подход к визуализации у пациентов с подозрением на инсульт в острейшем периоде неуместен. Некоторым пациентам вполне достаточно проведения бесконтрастной КТ для принятия соответствующего решения о ведении, с последующим использованием более современных методов визуализации головного мозга и сосудов с целью определения механизма развития инсульта, его патофизиологии и локализации. В других случаях для принятия обоснованного клинического решения может потребоваться проведение современных нейровизуализирующих исследований даже в течение первых 3–4,5 часа. Идейным лидерам необходимо отразить эти факты в будущих стандартах по лечению для улучшения качества оказания помощи при инсульте.
1. Alexandrov A.V., Schellinger P.D., Saqqur M., Barreto A., Demchuk A.M., Ribo M., et al. CLOTBUST and TUCSON Investigators. Reperfusion and outcomes in penumbra vs systemic tissue plasminogen activator clinical trials. Int J Stroke. 2011; 6:118–122.
2. Selim M., Kumar S., Fink J., Schlaug G., Caplan L.R., Linfante I. Seizure at stroke onset: should it be an absolute contraindication to thrombolysis? Cerebrovasc Dis. 2002;14:54–57.
3. Mehdiratta M., Selim M. Value of perfusion computed tomography in stroke mimics. Arch Neurol. 2007;64:1348–1349.
Источник
Данный системный подход на основе презентации Majda Thurnher и адаптирован для Radiology Assistant Robin Smithus.
Содержание.
Роль КТ и МРТ в диагностике инсульта.
Ранние признаки инфаркта на КТ и МРТ.
Введение.
Цель визуализации у пациентов с острым инфарктом.
- 1) исключить кровотечение.
- 2) дифференцировать мертвую ткань головного мозга и ткань в риске-пенумбры.
- 3) выявить стеноз или окклюзию экстра- и интракраниальных артерий.

Пенумбра: Окклюзия в СМА. Черным указано ткань с необратимыми изменениями или мертвая ткань. Красным выделена ткань-риска или пенумбра.
Ранние признаки инсульта на КТ.
КТ является золотым стандартом для выявления геморрагии в первые 24 часа. Геморрагии также выявляются на МРТ. На КТ возможно определить 60% инфарктов в первые 3-6 часов, остальную часть возможно выявить впервые 24 часа. Общая чувствительность КТ при диагностике инфаркта составляет 64% и специфичность 85%. Ниже представлены ранние признаки на КТ.
КТ ранние признаки инсульта.
- — Зона с гиподенсной плотностью головного мозга.
- — Обскурация чечевицеобразных ядер.
- — Симптом плотной СМА.
- — Островковый ленточный симптом.
- — Потеря островковых очертаний.
Гиподенсная зона головного мозга.
Причиной, по которой визуализируется зона ишемии с цитотоксическим отеком, является нарушение работы натрий-калиевого насоса, что в свою очередь связано со снижением количества АТФ.
Увеличение содержания воды в мозге на 1% приводит к снижению плотности головного мозга на КТ на 2,5 единицы Хаусфильда.
У пациента выше представленного гиподенсивная область головного мозга в правом полушарии. Вытекающий диагноз из данных находок — инфаркт так, как локализация средней мозговой артерии и вовлечение в патологический процесс белого и серого вещества, что типично для инфаркта.
Обнаружение в первые 6 часов гиподенсной зоны является специфичным признаком необратимого ишемического повреждения мозга.
У пациентов с клиникой инсульта и выявленным гиподенсной областью впервые 6 часов есть риск увеличения зона ишемии, ухудшения симптоматики и кровотечения, а также данная группа пациентов имеет более хуже ответ на проводимую медикаментозную терапию в сравнении с пациентами с клиникой инсульта, у которых данная область не выявлена.
Таким образом выявления гиподенсной зоны является неблагоприятным прогнозом. Соответственно, что если гиподенсная зона не выявлена, это благоприятный прогноз.
У данного пациента выявлен гиподенсная область — это инфаркт в области средней мозговой артерии — безвозвратная ишемия головного мозга.
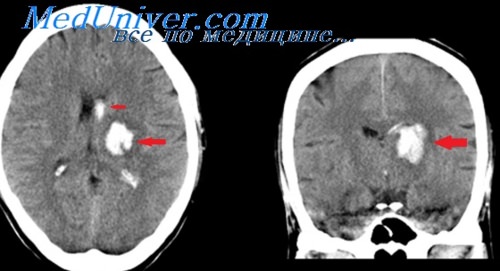
Обскурация чечевицеобразного ядра.
Обскурация чечевицеобразного ядра также ещё называют симптом расплывшегося пятна базальных ядер и является важным признаком инфаркта.
Данный симптом является одним из ранних изменений при инсульте и часто встречаемым признаком инфаркта. Базальные ганглии также часто поражаются при инсульте в средней мозговой артерии.
Обскурация чечевицеобразного ядра.
Островковый ленточный симптом.
Данный симптом включает в себя: гиподенсную зону и отек коры головного мозга в области островка. Данный симптом также относится к ранним проявлениям ишемии в средней мозговой артерии. Область головного мозга, относящаяся к средней мозговой артерии, очень чув- ствительна к гипоксии в связи с тем, что СМА не имеет коллатералей.
Дифференциацию стоит проводить с поражением ГМ при герпесном энцефалите.
Симптом плотной СМА.
Данный симптом проявляется в следствии тромбирования или эмболизации СМА.
У ниже представленного пациента симптом плотной СМА. На КТ ангиография визуализируется окклюзия СМА.
Гемморагический инсульт.
По статистике 15% инсультов в бассейне СМА являются геморрагическими.
Геморрагии хорошо визуализируются на КТ, а также отлично на МРТ при использовании Gradient ECHO.
КТА и КТ-перфузия.
После того, как лучевой диагност обнаружил область ишемии, используя КТ-ангиографию ищет тот сосуд, который вовлечён в патологический процесс.
Нормальная КТА.
Оцените ниже лежащие изображения после того, как оцените — продолжите чтение.
В данном случае признаки инфаркта едва уловимые. Гиподенсная зона в островковой области справа. В данном случае эти изменения соответствуют инфаркту, но у пожилых пациентов с лейкоэнцефалопатией тяжело отдифференцировать эти две разные патологии.
Вышележащие изображения — КТ-ангиография. После выполнения КТА — диагноз инфаркта в области СМА, как на ладоне.
КТ-перфузия (КТП).
При использовании КТ и МРТ-диффузии мы можем с уверенностью найти ту зону, которая ишемизирована, но не сможем сказать о зоне большой ишемической пенумбры (ткань риска).
При помощи перфузии можем ответить на вопрос, какая ткань находится в риске. По статистике 26% пациентам следовало бы выполнить перфузию для уточнения диагноза. Возможности МРТ перфузии и КТ сопоставимы.
Было проведено исследование для сравнения КТ и МРТ, при котором было установлено, что для выполнения КТ, КТА и КТП при условии, что у вас хорошо сложенная команда, требуется 15 минут.
В данном случае была выполнена только КТ так, как выявлено кровоизлияние.
В этом случае изначально выполнены КТ без контрастирования и КТ-перфузия так, как выявлен дефект перфузии было целесообразно выполнение КТ-ангиографии, на которой выявлено диссекция левой внутренней артерии.
МРТ при диагностике острого нарушения мозгового кровообращения.
На PD/T2WI и FLAIR выглядит гиперинтенсивно. На PD/T2WI и FLAIR последовательностях возможно диагностировать до 80% инфарктов впервые 24 часа, но впервые 2-4 часа после инсульта изображение также может быть неоднозначным.
На PD/T2WI и FLAIR продемонстрировано гиперинтенсивность в районе левой средней мозговой артерии. Обратите внимание на вовлечение в процесс лентиформного ядра и островковой доли.
Область с гиперинтенсивным сигналом на PD/T2WI и FLAIR соответствует гиподенсивной области на КТ, что в свою очередь прямой признак гибели клеток мозга.
Диффузно-взвешенное изображение.
DWI наиболее чувствительна к инсульту. В результате цитотоксического отека возникает дисбаланс внеклеточной воды к Броуновскому движению, поэтому данные изменения выявляются отлично на DWI. В норме протоны воды диффундируют внеклеточно, поэтому теряется сигнал. Высокая интенсивность сигнала на DWI указывает на ограничение протонов воды диффундировать внеклеточно.
Представлены ДВИ инфаркт передней, задней, средней мозговой артерии.
Обратите внимание на изображение и предположите, где патология.
После продолжите чтение.
Вывод:
Есть некоторая гиподенсность и отек в левой лобной доли со старостью борозд в сравнении с контр-латеральной стороной.
Далее DWI снимки того же пациента.
После просмотра DWI нет сомнения, что это инфаркт. Именно поэтому DWI называют инсульт последовательностью.
Когда мы сравниваем результаты на T2WI и DWI во времени, мы заметим следующее: В острой фазе T2WI норма, но со временем зона инфаркта станет гиперинтенсивной.
Гиперинтенсивность на T2WI достигает своего максимума между 7 и 30 дней. После этого сигнал начинает угасать.
На DWI гиперинтенсивная область в острой фазе, а затем становится более интенсивной с максимумом на 7 дней.
На DWI у пациента с инфарктом головного мозга визуализируется гиперинтенсивная область примерно на 3 недели после начала заболевания (при инфаркте спинного мозга на DWI визуализируется гиперинтенсивная область на одну неделю!).
На ADC будет сигнал низкой интенсивности с минимальной интенсивностью в первые 24 часа, после сигнал будет увеличиваться в интенсивности и, наконец, становится максимально интенсивным в хроническую стадию.
Псевдо-улучшение на DWI.
Псевдо-улучшение наблюдается на 10-15 день.
Слева показана норма на DWI.
На T2WI там могут быть гиперинтенсивная область в правой затылочной доле в сосудистой территории задней мозговой артерии. В T1WI после введения контрастного препарата на основе гадолиния визуализируется повышение сигнала (зона инфаркта указана стрелкой).
Псевдо-улучшение на ДВИ после 2 недельного инфаркта.
Прежде считалось, что гиперинтенсивный сигнал на DWI — это мертвые ткани. Новейшие исследования доказывают, что некоторые очаги из них вероятно могут быть потенциально обратимым повреждениям.
Это наглядно показано, если сравнить изображения одного и того же пациента DWI в острейшую фазу и Т2WI в хроническую фазу. Размер поражения на DWI намного больше.
МРТ перфузия.
Перфузия на МРТ сопоставима с КТ-перфузией. При МР-перфузии используется болюс с контрастным веществом Gd-DTPA. Т2 последовательности более чувствительны к изменению сигнала, поэтому используются для МР-перфузии.
Зона с дефектом перфузии является безвозвратно ишемизированной тканью или зоной пенумбры (ткань риска). При комбинировании диффузно-взвешенного изображения и перфузии есть возможность отдифференцировать зоны пенумбры и зоны безвозвратной ишемии.
На нижележащих изображениях слева представлена диффузно-взвешенное изображение, на котором возможно выявить ишемизированную ткань. Среднее изображение соответствует мр- перфузии, на котором визуализируется огромная область гипоперфузии. На крайне правом изображении diffusion-perfusion mismatch визуализируется зона ткани-риска, которая отмечена синим и возможно будет сохранена после терапии.
Ниже представлены изображения пациента, у которого были установлены неврологические проявления около часа назад. Постарайтесь выявить патологические изменения, а после продолжите чтение.
Данные изображения соответствуют норме, поэтому следует перейти к диффузно-взвешенному изображению. Взгляните на следующие изображения.
На DWI выявляется зона ограничения диффузии, и если после выполнения перфузии не будет выявляться зона перфузии, то следовательно нет смысла выполнять тромболизис.
На выше лежащих изображениях визуализируется инфаркт в бассейне СМА. На КТ четко визуализируются необратимые изменения. Далее представлены DWI и перфузия. При сопоставлении зон становится ясно, что не нужно выполнять тромболизис
Выше представлены ADC и DWI map.
При ознакомлении с перфузионными изображениями, то визуализируется несоответствие. В левом полушарии выявлена область гипоперфузии. Данный пациент абсолютный кандидат на тромболитическую терапию.
- Acute stroke: usefulness of early CT findings before thrombolytic therapyby R von Kummer et al.
Radiology 1997, Vol 205, 327-333, - Early CT finding in cerebral infarction: obscuration of the lentiform nucleusby N Tomura et al
Radiology 1988, Vol 168, 463-467 - State-of-the-Art Imaging of Acute Strokeby Ashok Srinivasan et al
RadioGraphics 2006;26:S75-S95
Источник
