Целлекс в лечении инсультов

Представлены результаты проспективного наблюдательного сравнительного исследования в параллельных группах (фаза IV) по определению влияния препарата Целлекс на динамику и сроки восстановления утраченных функций у пациентов с острым ишемическим инсультом на фоне базисной и тромболитической терапии. 60 пациентам с ишемическим инсультом была выполнена процедура системного тромболизиса. В контрольной группе (n = 30) проводилась стандартизированная базисная терапия. Больные основной группы (n = 30) дополнительно получали препарат Целлекс (0,1 мг один раз в сутки п/к в течение десяти дней). Использование лекарственного препарата Целлекс в составе комплексной терапии при ишемическом инсульте с применением тромболизиса позволило пациентам достичь более выраженного улучшения неврологического статуса (по Шкале тяжести инсульта Национального института здоровья США (National Institutes of Health Stroke Scale – NIHSS)) и повседневной активности (по индексу Бартел и шкале Рэнкина) по сравнению со стандартной терапией острых нарушений мозгового кровообращения.

Рис. 1. Динамика суммарного балла NIHSS в основной и контрольной группах
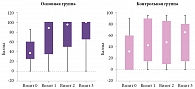
Рис. 2. Динамика степени выраженности нарушений жизнедеятельности по индексу Бартел в основной и контрольной группах
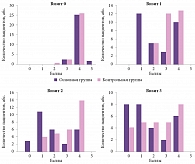
Рис. 3. Степень выраженности нарушений жизнедеятельности по модифицированной шкале Рэнкина в основной и контрольной группах на визитах 0, 1, 2, 3
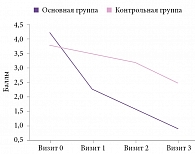
Рис. 4. Анализ эффективности по показателю «динамика степени выраженности нарушений жизнедеятельности» модифицированной шкалы Рэнкина
Острые нарушения мозгового кровообращения продолжают оставаться одними из наиболее распространенных и тяжелых поражений головного мозга [1–4]. За период 2008–2016 гг. показатель первичной заболеваемости инсультом в России вырос на 24,8%, составив 355,6 случаев на 100 тыс. населения. Вместе с тем благодаря активным мероприятиям по борьбе с сердечно-сосудистой патологией заболеваемость повторным инсультом в нашей стране уменьшилась с 1,09 в 2009 г. до 0,79 новых случаев на 1000 населения в 2014 г. [2]. Общая смертность от цереброваскулярных заболеваний в период с 2003 по 2014 г. снизилась на 39,7% [1, 5], а в период с 2008 по 2016 г. – на 45%, составив 123,0 на 100 тыс. населения.
В России, как и в большинстве стран мира, в структуре острых нарушений мозгового кровообращения преобладает ишемический инсульт (ИИ) [2, 6]. В качестве основных модифицируемых факторов риска ИИ на основании многочисленных проспективных и ретроспективных исследований в настоящее время рассматриваются артериальная гипертензия, гиперлипидемия, атеросклероз, гиперкоагуляция, васкулиты и др. [1, 7]. Знание этиопатогенетических аспектов инсульта, внедрение новых прогрессивных методов лечения заболевания позволяют достичь определенных успехов в решении проблемы острых нарушений мозгового кровообращения.
В ряду наиболее эффективных методов лечения достойное место занимает тромболитическая терапия. Системный тромболизис проводится в первые четыре с половиной часа после развития ИИ путем внутривенного введения тканевого активатора плазминогена (rt-PA, алтеплаза), который на сегодняшний день имеет самый высокий уровень доказательности (класс I, уровень А). Указания на применение метода есть во всех международных и российских клинических рекомендациях по ведению пациентов с ИИ [6, 8–10].
Внедрение тромболитической терапии в практику первичных сосудистых отделений и региональных сосудистых центров основано на данных о механизмах гибели нейронов при острой ишемии. Было показано, что при окклюзии церебральной артерии гибель нейронов происходит катастрофически быстро [11]. Тезис «Time is brain» («Время – мозг») стал своеобразным лозунгом в области тромболитической терапии ИИ [11, 12].
Формирование ядерной зоны ишемии с необратимыми изменениями как результат сложного каскада патобиохимических реакций завершается в течение нескольких минут с момента острого нарушения мозгового кровообращения. Данная область мозга окружена потенциально жизнеспособной зоной ишемической полутени, в которой снижен уровень кровотока, но в целом сохранен энергетический метаболизм и присутствуют только функциональные, но не структурные изменения. В последующие 6–12 часов в зоне ишемической полутени может происходить отсроченная гибель нейронов. Очевидно, что восстановление циркуляции путем реканализации окклюзированной интракраниальной артерии способствует сохранению обратимо поврежденной ткани мозга в зоне пенумбры. Это позволяет уменьшить размеры инфаркта и выраженность неврологического дефицита [6, 11, 12].
Необходимо помнить, что, несмотря на высокую эффективность, тромболитическая терапия может сопровождаться развитием осложнений. Одно из наиболее тяжелых – геморрагическая трансформация инфаркта мозга, которая связана с достижением реканализации и обусловлена развитием острой эндотелиальной дисфункции, реперфузионным повреждением мозга [10, 12].
Логично предположить, что применение алтеплазы в комбинации с тем или иным нейропротектором будет способствовать сохранению жизнеспособности нейронов в пенумбре, позволит расширить диапазон «терапевтического окна» и снизить частоту геморрагических осложнений [13]. Нейропротективная и нейрометаболическая терапия направлена на уменьшение повреждения, которое вызвано патологическими процессами, протекающими в веществе мозга при его ишемическом поражении, а также на активацию процессов нейропластичности и нейрорепарации [1, 14–16].
Именно такими свойствами обладает современный отечественный препарат Целлекс, тканеспецифичный высокомолекулярный белково-полипептидный комплекс с массой протеинов 10–250 кДа, полученный из эмбриональной мозговой ткани поросят. Он содержит более 1200 сигнальных белков и полипептидов, в том числе факторы роста и дифференцировки нервных клеток и сосудов. Препарат обладает как первичным нейропротективным действием, снижая избыток возбуждающих аминокислот, так и вторичным нейропротективным действием, подтвержденным клиническими и экспериментальными исследованиями [17–21]. Активация препаратом вторичной нейропротекции в виде стимуляции редупликации ДНК и деления клеток (нейроны, глия), запуска синаптогенеза, торможения апоптоза путем восстановления сигналов аутофагии, улучшения тканевой иммунорегуляции с торможением иммуногенной цитотоксичности макрофагов, регуляции нейромедиации с торможением спиловера нейротрансмиттеров объясняет его эффективность при ИИ [19].
Для подтверждения вышеизложенной гипотезы было проведено российское проспективное наблюдательное сравнительное исследование в параллельных группах (IV фаза), в котором приняли участие три исследовательских центра (первичные сосудистые отделения и региональный сосудистый центр).
Цель исследования
Определение влияния препарата Целлекс на динамику и сроки восстановления утраченных функций у пациентов с острым ИИ на фоне базисной и тромболитической терапии.
Материал и методы
В исследование включено 60 пациентов с установленным в соответствии с критериями Международной классификации болезней 10-го пересмотра и данными нейровизуализации диагнозом ИИ в системе внутренней сонной артерии и вертебрально-базилярном бассейне независимо от патогенетического подтипа в возрасте от 35 лет (мужчины) и 45 лет (женщины) с гемипарезом/монопарезом или афатическими нарушениями в структуре неврологических нарушений, а также их сочетанием, суммарным баллом по Шкале тяжести инсульта Национального института здоровья США (National Institutes of Health Stroke Scale – NIHSS) не менее 4.
Пациенты разделены на две группы, сопоставимые по возрасту, тяжести инсульта, сосудистому бассейну, в котором произошло нарушение кровообращения, времени с момента развития ИИ, клиническим проявлениям по NIHSS, шкале Глазго, индексу Бартел. Группы различались только по полу: в основной группе было 11 (36,7%) мужчин и 19 (63,3%) женщин, в контрольной – 20 (66,7%) мужчин и 10 (33,3%) женщин (р = 0,038).
Основная группа (n = 30) на фоне стандартизированной базисной терапии получала Целлекс, стерильный раствор для подкожного введения по 0,1 мг один раз в сутки в течение десяти дней. Первая инъекция препарата Целлекс выполнялась перед проведением процедуры тромболизиса.
Контрольная группа (n = 30) получала стандартизированную базисную терапию, согласно действующему федеральному стандарту оказания медицинской помощи для данной группы пациентов.
Всем пациентам основной и контрольной групп проводилась процедура тромболизиса в соответствии с инструкцией по медицинскому применению препарата Актилизе (алтеплаза): внутривенное введение в дозе 0,9 мг/кг, максимально – 90 мг (10% дозы болюсно, последующая инфузия в течение 60 минут).
Для определения эффективности препарата на четырех визитах: визит 0 (в течение «терапевтического окна», до проведения тромболитической терапии), визит 1 (первые сутки от начала заболевания), визит 2 (пятые сутки от начала заболевания) и визит 3 (19-е сутки от начала заболевания) – анализировались следующие показатели:
- частота возникновения геморрагической трансформации (с помощью рентгеновской компьютерной томографии головного мозга до проведения тромболизиса, через 24 часа и на пятые сутки);
- динамика степени выраженности неврологических нарушений по NIHSS;
- динамика степени выраженности нарушений жизнедеятельности по индексу Бартел;
- динамика степени выраженности нарушений жизнедеятельности по модифицированной шкале Рэнкина.
В исследование были включены пациенты преимущественно с ИИ в системе внутренней сонной артерии (n = 46, 76,7%), число пациентов с ИИ в системе вертебрально-базилярного бассейна было значительно меньше – 14 (23,3%). Все пациенты основной и контрольной групп были госпитализированы в стационар в среднем через 1 час 36 минут ± 36 минут (р = 0,210) от появления первых симптомов заболевания. Всем пациентам обеих групп был выполнен системный тромболизис в течение 2 часов 34 минут ± 40 минут от начала инсульта (р = 0,052). Таким образом, группы были сопоставимы по основным показателям. Завершили исследование 57 человек: три пациента из контрольной группы умерли, случаев смерти пациентов в основной группе не было. Вероятно, относить снижение частоты смертельных исходов при ИИ у пациентов, получавших тромболитическую терапию в сочетании с Целлексом, на счет Целлекса было бы преждевременно, для этого необходимы дальнейшие наблюдения.
Статистическая обработка выполнялась при помощи пакета для статистического анализа Statistica. Все непрерывные данные представлены при помощи описательной статистики в виде среднего значения, стандартного отклонения максимальных и минимальных значений, медианы, интерквартильного интервала. Все категориальные конечные данные обобщены с указанием частот и процентных соотношений, использованием критерия Манна – Уитни, рангового дисперсионного анализа Фридмана, критерия хи-квадрат, двустороннего критерия Фишера.
Результаты исследования и их обсуждение
Наиболее частым и грозным осложнением тромболитической терапии является геморрагическая трансформация ИИ [22, 23], поэтому прежде всего была сопоставлена частота этого осложнения в сравниваемых группах, в том числе по данным рентгеновской компьютерной томографии головного мозга перед тромболитической терапией, через 24 часа и на пятые сутки. В основной группе в ходе исследования было зарегистрировано три (10,0%) случая развития асимптомного внутримозгового кровоизлияния, в контрольной – пять (16,7%) (два – асимптомного внутримозгового кровоизлияния, три – симптомного). В целом, частота симптомных геморрагических трансформаций составила 5%, что сопоставимо с данными литературы [22, 23]. Несмотря на то что межгрупповые различия частоты геморрагической трансформации ИИ не достигли степени статистической достоверности (р = 0,707), имеющаяся тенденция может свидетельствовать о пользе нейропротективного эффекта Целлекса при тромболитической терапии. Оценка геморрагической трансформации проводилась в соответствии с критериями ECASS (European Australasian Cooperative Acute Stroke Study). Асимптомные геморрагические инфаркты развивались по типу петехиального пропитывания зоны ишемического повреждения без объемного эффекта, симптомные в одном случае – сливающиеся петехиальные кровоизлияния, в двух – паренхиматозные гематомы
Безусловный интерес представляет динамика состояния больных ИИ в ходе проводимой терапии. Результаты анализа данных NIHSS, проводимого с помощью рангового дисперсионного анализа Фридмана, свидетельствуют о том, что комплексная терапия приводила к статистически значимому уменьшению тяжести неврологической симптоматики в остром периоде ИИ как в основной, так и в контрольной группе (р = 0,000).
Сравнение групп по данным NIHSS на визитах 1–3 с помощью критерия Манна – Уитни продемонстрировало более выраженную динамику в основной группе. Уже через сутки (на визите 1) среднее значение балла по NIHSS составило в основной группе 1,2 против 4,2 в контрольной группе (р = 0,014). Результаты представлены на рис. 1. Вместе с тем снижение суммарного балла NIHSS в контрольной группе продолжалось и достигло 2,4 балла (среднее значение) к пятым суткам и 2,0 балла (среднее значение) к 19-м суткам, что привело к нивелированию статистических различий между основной и контрольной группами на визитах 2 и 3 (р = 0,083 и р = 0,198 соответственно).
Для оценки степени выраженности нарушений повседневной жизнедеятельности использовали индекс Бартел. В начале исследования статистически значимых различий по индексу Бартел между основной и контрольной группами не наблюдалось (р = 0,099). В ходе комбинированной терапии так же, как и при анализе предыдущих данных, происходило уменьшение степени выраженности нарушений жизнедеятельности у пациентов обеих групп (р = 0,000). Однако уже через сутки от начала заболевания у больных, получавших Целлекс, динамика улучшения состояния была более выраженной, сохраняясь таковой и при последующих обследованиях на 5-е и 19-е сутки от начала заболевания (р = 0,029, р = 0,000 и р = 0,000 соответственно) (рис. 2).
Первоначально в обеих группах у пациентов отмечалась средняя, среднетяжелая и тяжелая степень нарушения дееспособности по модифицированной шкале Рэнкина, статистически значимых межгрупповых различий не наблюдалось (р > 0,05). В ходе исследования степень выраженности нарушений жизнедеятельности по модифицированной шкале Рэнкина снижалась как в основной, так и в контрольной группе. Однако в группе, получавшей Целлекс, наблюдалась более значительная динамика снижения степени выраженности нарушений жизнедеятельности, что способствовало переходу подавляющего числа пациентов из категории «тяжелых» (с выраженным нарушением жизнедеятельности, неспособностью ходить, справляться с физическими потребностями без посторонней помощи, либо прикованных к постели) в категорию «легких» (с отсутствием существенных нарушений жизнедеятельности, несмотря на некоторые симптомы болезни, не мешающие выполнять повседневные обязанности) или регрессу неврологической симптоматики. Статистически значимыми были различия между основной и контрольной группами на визите 1 (по градациям «1 балл» и «3 балла», р = 0,0001 и р = 0,015 соответственно), на визите 2 (по градации «4 балла», р = 0,029) (рис. 3).
Таким образом, за время наблюдения у больных, получавших Целлекс, процесс восстановления утраченных функций происходил гораздо успешнее по сравнению с группой контроля. Рисунок 4 наглядно иллюстрирует существенную роль Целлекса в регрессе неврологического дефицита: к 19-м суткам от начала заболевания разница в сумме баллов по модифицированной шкале Рэнкина между основной и контрольной группами достигла 1,5 балла (р
Важно отметить, что, по мнению как врачей, так и пациентов, значительный терапевтический эффект Целлекса сочетался с его хорошей переносимостью. Серьезных нежелательных явлений и побочных эффектов, связанных с приемом препарата, в ходе исследования зарегистрировано не было, что свидетельствует о безопасности его применения.
Заключение
Необходимо выделить как минимум два аспекта использования Целлекса при ИИ. Во-первых, в данном исследовании, как и в предыдущих экспериментальных и клинических работах, подтвердилась эффективность препарата, который способствовал регрессу неврологического дефицита, расширению возможности реабилитации пациентов. Во-вторых, выявленная тенденция по уменьшению числа случаев геморрагической трансформации инфаркта мозга на фоне тромболитической терапии может свидетельствовать о нейропротективном влиянии препарата на зону пенумбры путем снижения степени реперфузионного повреждения мозга при реканализации артерии.
Основными выводами исследования стали доказанные преимущества добавления Целлекса к стандартной схеме лечения больных ИИ, получавших тромболитическую терапию. Применение Целлекса позволило достичь более выраженного регресса неврологического дефицита и повысить уровень повседневной активности пациентов. Целлекс продемонстрировал хорошую переносимость, что открывает перспективы его применения в ургентной ангионеврологии.
Источник
В настоящее время острые нарушения мозгового кровообращения являются наиболее частым жизнеугрожающим заболеванием и одной из главных причин инвалидизации не только в России, но и в мире. По данным Всемирной федерации неврологических обществ, ежегодно в мире регистрируется около 15 млн инсультов. В России заболеваемость инсультом составляет 3,4 на 1000 человек в год, при этом около 30% инсультов приводят к летальному исходу в остром периоде [1, 2]. В течение последующего года умирают еще 10—15% больных. У 80% выживших после инсульта развивается та или иная степень ограничений в повседневной жизни [3]. В нашей стране инвалидизация вследствие инсульта (3,2 на 10 000 населения в год) опережает другие заболевания [4].
Существенный негативный вклад в инвалидизацию больных после инсульта вносят когнитивные нарушения, поскольку зачастую при отсутствии четкой очаговой симптоматики именно расстройства когнитивной сферы определяют тяжесть состояния больного и трудности в процессе его бытовой и профессиональной адаптации. В течение первого года после ишемического инсульта деменция развивается в 25—30% случаев [5]. Приблизительно в 1/3 случаев она является результатом декомпенсации или активизации предшествующего нейродегенеративного процесса, в остальных случаях постинсультная деменция обусловлена сосудистой мозговой недостаточностью [6—8]. У больных с постинсультной деменцией увеличивается риск развития повторного инсульта, что может быть связано с трудностями проведения вторичной профилактики у этой группы пациентов. Есть данные о том, что наличие выраженного когнитивного дефицита негативно влияет и на восстановление двигательных функций [9—12].
Особой формой когнитивных расстройств является афазия, которая представляет собой нарушение сформировавшейся речи, возникающее при очаговых поражениях коры и прилежащей подкорковой области доминантного полушария головного мозга и являющееся системным расстройством различных форм речевой деятельности при сохранности элементарных форм слуха и движений речевого аппарата [13]. Тотальная и сенсорная афазии в остром периоде отмечаются у 84% больных с кровоизлияниями и у 50% — с ишемическим инсультом в случае поражения доминантного полушария, спустя несколько месяцев сенсомоторная афазия сохраняется у 12—13% больных [6]. Любая форма когнитивных нарушений в целом и речи, в частности, ведет к изменению личности, к нарушению общей и вербальной коммуникации. Меняется поведение больного, его эмоциональное состояние, качество жизни.
Длительное время широко обсуждается вопрос о применении препаратов нейропротективного действия в остром периоде инсульта. Большинство исследователей склоняются к мнению, что раннее назначение нейропротекторов позволяет улучшить прогноз восстановления нарушенных функций, увеличить период «терапевтического окна», уменьшить размеры очага повреждения головного мозга [14—16]. В настоящее время активно ведется поиск эффективных лекарственных средств для первичной и вторичной нейропротекции, проводятся исследования, доказывающие необходимость назначения данных препаратов в остром периоде инсульта.
В настоящее время разработан новый оригинальный нейропротективный препарат для парентерального введения — целлекс (ЗАО «Фарм-Синтез», Россия). Он представляет собой белково-пептидный комплекс из эмбрионального головного мозга свиней, который способен обеспечивать регенерацию нервной ткани человека. Целлексобладаетпрямым нейрорепаративным действием, что принципиально отличает его от нейротропных средств из других групп. Прямое репаративное действие целлекса на нейрональный и глиальный клеточные пулы нервной ткани доказано доклиническими исследованиями: в экспериментах с лабораторными животными на моделях острого ишемического повреждения мозга методом фотоиндуцированного тромбоза, на клеточных культурах нейронов мозжечка в модели глутаматной токсичности, а также на моделях глобальной преходящей и неполной гипоксиях мозга.
Полученные результаты явились основанием для проведения клинического исследования «Многоцентровое рандомизированное сравнительное открытое клиническое исследование эффективности и безопасности препарата целлекс в лечении больных с острым нарушением мозгового кровообращения», в котором было предусмотрено изучение влияния целекса на когнитивные и речевые нарушения.
Цель исследования — изучение действия целлекса на восстановление когнитивных и речевых функций в остром периоде инсульта.
Многоцентровое сравнительное открытое клиническое исследование эффективности и безопасности препарата целлекс в лечении больных с острым инсультом проводилось на 6 клинических базах. В исследование были включены 180 пациентов с инсультом. Диагноз острого нарушения мозгового кровообращения, характер и локализация инсульта устанавливались согласно критериям регистра инсульта Национальной ассоциации по борьбе с инсультом (НАБИ) [5], на основании данных анамнеза (предшествующие заболевания сердечно-сосудистой системы, показатели артериального давления, характер развития неврологических симптомов), клинических данных (неврологический осмотр с оценкой выраженности общемозговых, оболочечных и очаговых симптомов) и данных дополнительных исследований (лабораторные исследования крови и цереброспинальной жидкости, осмотр глазного дна, компьютерная или магнитно-резонансная томография головного мозга, транскраниальная допплерография и дуплексное сканирование сосудов головного мозга с эмболодетекцией).
Критерии включения больных в настоящее исследование: мужчины в возрасте от 35 до 80 лет включительно; женщины в возрасте от 55 до 80 лет включительно, находящиеся в постменопаузальном периоде не менее 2 лет; больные, подписавшие письменное информированное согласие или их ближайшие родственники (при крайней тяжести пациента); больные с острым ишемическим или геморрагическим инсультом в соответствии с критериями МКБ-10, подтвержденными при рентгеновской компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головного мозга, госпитализированные в течение 1-х суток от развития заболевания.
Критериями исключения являлись: крайняя тяжесть пациента с уровнем сознания ниже 5 баллов по шкале комы Глазго (кома III cт. по отечественной классификации); регресс неврологической симптоматики в течение первых 24 ч от начала заболевания (транзиторная ишемическая атака); наличие у пациента заболеваний или состояний, указанных в противопоказаниях к назначению препарата целлекс: эпилепсия, маниакальный психоз, продуктивный бред, делирий; наличие в анамнезе анафилактических реакций на препараты белковой природы (альбумин, плазма крови, иммуноглобулины, сыворотки); наличие злокачественного новообразования; острые и/или хронические бактериальные и вирусные заболевания в стадии обострения; аутоиммунные заболевания в стадии декомпенсации, сопровождающиеся системным васкулитом; хроническая печеночная или почечная недостаточность в стадии обострения; выраженная или неконтролируемая патология сердца; предшествующая нейротропная метаболическая терапия в течение 14 дней перед госпитализацией пациента.
Среди включенных в исследование больных 147 (81,7%) перенесли ишемический инсульт и 33 (18,3%) — геморрагический инсульт.
К характеристике выборки можно также добавить, что у 148 (82%) больных были выявлены признаки атеросклероза. В 135 (75%) случаях отмечалось сочетание атеросклероза с артериальной гипертензией. В 158 (87,8%) наблюдениях имелась гипертоническая болезнь. Сахарный диабет, сочетающийся с атеросклерозом и артериальной гипертензией, выявлялся у 14 (7,8%) больных. В 78 (43,3%) наблюдениях определялись признаки ишемической болезни сердца, 15 (8,3%) больных ранее перенесли инфаркт миокарда. У 37 (20,5%) больных отмечалась постоянная форма мерцательной аритмии: на фоне коронарокардиосклероза — у 29, на фоне ревматизма — у 8; 8 (4,4%) пациентов ранее перенесли инсульт в том же сосудистом бассейне, из них у 3 этому предшествовали транзиторные ишемические атаки. Все больные были доставлены в стационар в течение первых суток заболевания.
Целлекс применялся на фоне стандартной базисной терапии в виде раствора для подкожного введения по 0,1 мг 1 раз в сутки первые 10 дней и с 21-х по 27-е сутки заболевания. Все препараты, не входящие в стандартную базисную терапию, обладающие нейротропным, антигипоксантным действием, были запрещены к применению на протяжении всего срока исследования. В случае, когда прием данных препаратов на фоне базисной терапии был неизбежен, пациент из исследования исключался.
В зависимости от особенностей терапии больные были разделены на две группы — основную и группу сравнения.
В основную группу из 180 вошли 90 (50%) больных, которым на фоне базисной терапии был назначен целлекс. Их средний возраст был 61,4±9,5 года. Группу сравнения также составили 90 (50%) пациентов, получавших только базисную терапию. Их средний возраст был 62,2±8,9 года.
Кроме того, в зависимости от тяжести состояния больные основной группы и группы сравнения были дополнительно разделены на три подгруппы. При определении тяжести состояния учитывались выраженность изменений сознания и других общемозговых симптомов, оболочечной симптоматики, вегетотрофических расстройств, очаговых неврологических нарушений на момент поступления в клинику. Разделение по тяжести состояния проводилось в соответствии со шкалой инсульта (NIHSS). Легкой степени соответствовали 0—6 баллов, средней — 7—14 баллов, тяжелой — 15 и выше баллов.
В основной группе легкая степень тяжести состояния была определена у 21 (23,3%) больного, средняя — у 49 (54,4%) пациентов и тяжелая — у 20 (22,2%). В группе сравнения легкая степень — в 36 (40%) случаях, средняя — в 44 (49%) и тяжелая — в 10 (11%).
Распределение больных в выделенных группах и подгруппах по возрасту, полу, степени тяжести, характеру и бассейну поражения представлено в табл. 1 и 2.
 Таблица 1. Распределение больных основной группы и группы сравнения по полу, типу инсульта, тяжести состояния и бассейну поражения в группе целлекс Примечание. ЛСМА — левая средняя мозговая артерия; ПСМА — правая средняя мозговая артерия; ВББ — вертебрально-базилярная система; ЛП — левое полушарие; ПП — правое полушарие; САК — субарахноидальное кровоизлияние.
Таблица 1. Распределение больных основной группы и группы сравнения по полу, типу инсульта, тяжести состояния и бассейну поражения в группе целлекс Примечание. ЛСМА — левая средняя мозговая артерия; ПСМА — правая средняя мозговая артерия; ВББ — вертебрально-базилярная система; ЛП — левое полушарие; ПП — правое полушарие; САК — субарахноидальное кровоизлияние.
 Таблица 2. Распределение больных в изученных группах по показателям состояния высших психических функций
Таблица 2. Распределение больных в изученных группах по показателям состояния высших психических функций
Всем больным проводился мониторинг основных физиологических показателей (артериальное давление, частота сердечных сокращений, электрокардиография, частота дыхания, температура тела, гликемия) в первые 48 ч от начала развития инсульта 4—6 раз в сутки в зависимости от тяжести состояния больного. Осуществлялись также коррекция и поддержание показателей гемодинамики, дыхания, водно-электролитного обмена и обмена глюкозы, коррекция отека мозга и повышенного внутричерепного давления, адекватная нутритивная поддержка, профилактика и борьба с осложнениями.
Оценка динамики нарушения высших корковых функций проводилась по тесту ТИПК (Информация—Память—Концентрация внимания) и ОР — опросник речи). Уровень сохранности сознания больных в остром периоде инсульта оценивали также в соответствии со шкалой комы Глазго: значения 8 баллов и ниже свидетельствовали о наличии комы, 9—12 баллов — от сопора до оглушения, 13—15 баллов — от легкой заторможенности до ясного сознания.
Статистическая обработка полученных результатов проводилась с использованием пакета программ Microsoft Exсel 2003 и Statistica 6.0 с использованием пакетов ANOVA и DENOVA. При нормальном распределении признака применялись t-критерий Стьюдента и дисперсионный анализ с повторными измерениями, при распределении, признака, отличного от нормального, — ранговый дисперсионный анализ, критерии знаков и парных сравнений Вилкоксона, для тестирования зависимости — точный критерий Фишера. Различия считались статистически достоверными при p<0,05.
Полное 4-недельное исследование закончили 168 больных; 4 больных выведены по объективным причинам: выявление метастатического поражения мозга, развитие алкогольного делирия, перевод в нейрохирургическое отделение для оперативного лечения внутримозговой гематомы, перевод в стационар другой больницы по настоянию родственников. Из 3 умерших больных группы сравнения у 1 пациентки смерть наступила в результате тромбоэмболии легочной артерии, у 1 пациента развился острый инфаркт миокарда на фоне пароксизма мерцательной аритмии, у 1 пациентки к 3-м суткам отмечалось нарастание общемозговой и очаговой неврологической симптоматики с отеком мозга. Из 5 умерших больных, получавших целлекс, у 1 пациента поставлен патологоанатомический диагноз — опухоль головного мозга, у 1 пациента, поступившего в крайне тяжелом состоянии, отмечалось нарастание отека с вклинением ствола мозга к 3-м суткам, у 3 пациентов, поступивших в тяжелом состоянии, отмечалось прогрессивное нарастание очагового неврологического дефицита и общемозговой симптоматики с декомпенсацией сопутствующей патологии (у 1 пациентки — сахарного диабета 2-го типа и мерцательной аритмии, у 1 пациента — печеночной недостаточности на фоне хронического алкоголизма, у 1 пациента — выраженное прогрессирование сердечно-сосудистой недостаточности на фоне несостоятельности кардиостимулятора).
При анализе состояния высших психических функций по клиническим шкалам (средний балл NIHSS; средний балл расстройств сознания, средние значения по ОР) сравниваемые группы исходно достоверно различались: состояние этих функций у больных, лечившихся целлексом, изначально было достоверно тяжелее, чем в группе сравнения (см. табл. 2).
Оценка динамики неврологического дефицита по клиническим шкалам от 1-х суток к 3, 6, 10, 21-м и 28-м суткам проводилась методом сравнения средних изменений клинического балла в исследуемых группах с применением t-критерия Стьюдента для независимых выборок. Исследование значимости различий между показателями в контрольных точках проводилось методом дисперсионного анализа.
При сравнении пациентов основной группы по тяжести заболевания было установлено, что больные с состоянием средней тяжести, получавшие целлекс, достоверно отличались от группы сравнения более быстрым регрессом неврологического дефицита по нарушениям высших корковых функций по ТИПК (р=0,047) и речевым нарушениям (р=0,048) к 3-м суткам. Эти данные обобщены в табл. 3. В группе с легким неврологическим дефицитом такие различия отсутствовали, что, вероятно, связано с эффектом «потолка», который наблюдается при подобных исследованиях [17], а в группе тяжелых пациентов такая оценка по указанной шкале оказалась невозможной в связи с нарушениями сознания (достоверная разница по улучшению сознания в группе тяжелых пациентов наблюдалась только к 6-м суткам от начала заболевания).
 Таблица 3. Динамика клинических показателей у наблюдавшихся больных Примечание. Группа в целом — без разделения по тяжести; показатель ТИПК-дельта.
Таблица 3. Динамика клинических показателей у наблюдавшихся больных Примечание. Группа в целом — без разделения по тяжести; показатель ТИПК-дельта.
Отмечено улучшение высших корковых функций по ТИПК к 21-м суткам в общей группе больных с ишемическим инсультом (р=0,005), в том числе у больных с малым ишемическим инсультом (р=0,031) (табл. 1). Столь позднее появление изменений (на 21-е сутки), возможно, связано с исходно более тяжелым состоянием пациентов, получавших целлекс (табл. 3).
Отсутствие достоверных различий в группах ишемического инсульта с поражением ВББ и геморрагического инсульта, вероятно, связано с недостаточностью выборки (26 и 31 соответственно), а также особенностями локализации когнитивных функций преимущественно в коре больших полушарий головного мозга.
Проведенное исследование эффективности применения целлекса на фоне базисной терапии в остром периоде ишемического инсульта подтвердило его нейропротективное действие.
Получены достоверные данные о положительном влиянии целлекса в дозах 0,1 мг/мл на восстановление когнитивной и речевой функций, что свидетельствует об ускорении регрессии неврологического дефицита и возможности снижения уровня инвалидизации пациентов. Применение целлекса в остром и раннем реабилитационном периодах ишемического и геморрагического инсультов, особенно в группах пациентов со среднетяжелым и тяжелым течением заболевания, привело также к выраженному регрессу общемозговой и очаговой неврологической симптоматики с достоверной положительной динамикой клинического балла по NIHSS.
Нейропротективное действие целлекса, по-видимому, осуществляется первично за счет прерывания апоптоза в зоне пенумбры, уменьшения перифокального отека, реперфузии очага, стимуляцией нейрогенеза с направленной миграцией нейрональных стволовых клеток и нейробластов к области повреждения и вторично — путем нейропротекции в виде стимуляции редупликации ДНК и деления клеток (нейроны, глия), запуска синаптогенеза, улучшения тканевой иммунорегуляции с торможением иммуногенной цитотоксичности и регуляция нейромедиации. Указанные процессы ускоряют восстановление нарушенных когнитивных функций, расстройств речи, способствуя профилактике постинсультной деменции и увеличению реабилитационного потенциала, что приводит к ускорению восстановления трудоспособности и социальной адаптации пациентов.
