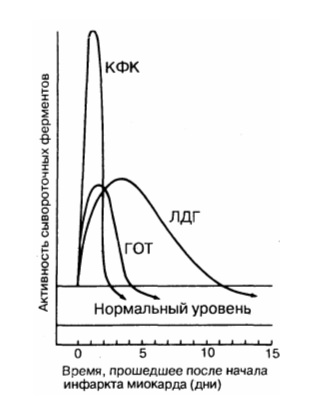
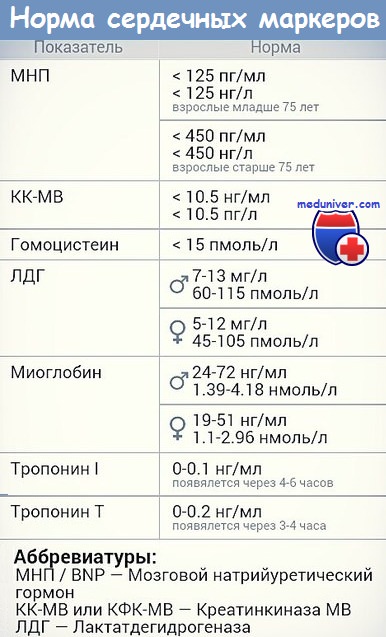
Биохимические исследование инфаркте миокарда

При
инфаркте миокарда (ИМ) в результате
некроза клеток сердечной мышцы в
кровеносное русло попадают содержащиеся
в них ферменты и белки. По их наличию,
времени появления и концентрации в
плазме крови можно оценить ущерб,
нанесенный сердечной мышце. Эти сведения
дополняют данные ЭКГ и помогают в
ранней диагностике ИМ, что позволяет
своевременно избрать правильную тактику
лечения.
Идеальный
биохимический маркер должен обладать
наивысшей специфичностью и чувствительностью
в отношении некроза миокарда, в течение
короткого времени после начала симптомов
ИМ достигать в крови диагностически
значимого уровня, этот уровень должен
сохраняться в течение многих дней. В
настоящее время маркера, полностью
отвечающего всем этим требованиям, не
существует, поэтому для диагностики ИМ
рекомендуется параллельно использовать
два маркера — “ранний” и “поздний”.
Содержание “раннего” маркера при
ИМ диагностически значимо повышается
в крови в первые часы заболевания,
“поздний” —достигает диагностически
значимого уровня только через 6—9 ч, но
обладает высокой специфичностью в
отношении некроза миокарда.
Ранние
маркеры некроза миокарда:
Миоглобин
МВ-КФК
(сердечная форма креатинфосфокиназы
— КФК)Сердечная
форма белка, связывающего жирные кислоты
(сБСЖК)
Поздние
маркеры некроза миокарда:
Лактатдегидрогеназа
(ЛДГ)Аспартатаминотрансфераза
(АсАТ)Сердечные
тропонины I и Т
Среди
множества биохимических маркеров,
которые могут менять свою концентрацию
в плазме крови при ИМ, наиболее
кардиоспецифическими являются тропонины,
МВ-фракция креатенинфосфокиназы
(КФК-МВ) и миоглобулин, которые и
представляют наибольшую диагностическую
ценность.
Тропонин
– является ферментом «быстрого
реагирования», поскольку попадает в
периферический кровоток из зоны некроза
уже в первые часы повреждения миокарда.
Тропонины Т и I присутствуют только в
клетках миокарда, поэтому повышение
их концентрации в крови является
достоверным признаком ИМ и показателем
его распространенности. Отрицательный
тропониновый тест вначале сердечного
приступа и через 12 часов позволяет
исключить у больного ИМ и диагностировать
нестабильную стенокардию. Даже
незначительное повышение уровня
тропонинов в периферической крови через
6-12 часов после болевого приступа
расценивается как признак ишемии
миокарда ведущей к некрозу и позволяет
выявить ИМ без явных клинических
симптомов и ЭКГ-признаков заболевания.
МВ-фракция
креатенинфосфокиназы (МВ-КФК)
содержится преимущественно в клетках
миокарда, но в небольшом количестве
присутствует и в скелетных мышцах,
поэтому активность этого фермента в
крови может повышаться при повреждении
не только сердечной мышцы, но и других
мышечных групп. Судить о повреждении
миокарда на фоне сердечного приступа
позволяет нарастание активности МВ-КФК
в динамике. Для диагностики ИМ в первые
сутки от начала сердечного приступа ее
определяют 2-3 раза каждые 8 часов. Три
отрицательных результата позволяют
исключить ИМ, а нарастание концентрации
этого фермента в крови с высокой долей
вероятности свидетельствует об ИМ.
Уровень активности MB – КФК позволяет
определить величину инфаркта миокарда
и тяжесть заболевания.
Миоглобин
— очень ранний и чувствительный, но
менее специфичный маркер ИМ, поскольку
содержание этого мышечного белка в
крови может увеличиваться и по другим
причинам. Миоглобин при сердечном
приступе появляется в крови еще до
формирования очага некроза, на стадии
выраженного ишемического повреждения
сердечной мышцы. Повышение уровня
миоглобина в 10 раз и больше указывает
на некроз мышечных клеток.
Лактатдегидрогеназа
(ЛДГ)
—
фермент, принимающий участие в реакциях
гликолиза, катализируя превращение
лактата в пируват, при этом образуется
NADH. ЛДГ имеет пять изо-энзимов. В сердечной
мышце содержится преимущественно
изоэнзим ЛДГ-1. При ИМ концентрация ЛДГ
начинает превышать нормальный уровень
через 14—48 ч после начала симптомов,
достигает максимального значения на
3—6-е сутки заболевания и возвращается
к норме на 7—14-е сутки болезни. ЛДГ-1 была
обнаружена также в эритроцитах, почках,
мозге, желудке, повышение концентрации
этого белка в крови больных далеко не
всегда связано с некрозом миокарда.
Отношение ЛДГ-1/ЛДГ-2, превышающее 0,76,
обладает 90% специфичностью при выявлении
некроза миокарда. Это соотношение может
увеличиваться и в случае отсутствия
ИМ, если у больного имеются массивный
гемолиз, мегалобластическая анемия,
распространенное повреждение скелетных
мышц, тяжелое заболевание печени. Из-за
позднего повышения концентрации ЛДГ в
сыворотке крови этот маркер не применяется
для ранней диагностики ИМ и суждения
об успехе тромболитической терапии,
однако ЛДГ длительно использовалась
для диагностики ИМ в поздние сроки
заболевания.
Аспартатаминотрансфераза
(АсАТ)
– фермент, который катализирует
преобращение оксалоацетата в аспартат,
перенося NH3 на первую молекулу. Вторым
продуктом реакции является α-кетоглутарат.
Реакция играет важную роль в высвобождении
NH3 из аминокислот, который затем
перерабатывается в цикле мочевины, так
как аспартат, полученный в процессе
реакции, нужен для образования
аргининосукцината. У больных ИМ уровень
АсАТ превышает норму через 8—12 ч после
начала боли, достигает максимального
значения к 24—З6-му часу и возвращается
к норме за 3—4 дня. Большое количество
этого фермента содержится в тканях
печени, что сильно снижает его специфичность
в отношении некроза миокарда. АсАТ
неудобна как для ранней, так и для поздней
диагностики ИМ, она используется только
в сочетании с более чувствительными и
специфичными маркерами. Низкая
специфичность в отношении некроза
миокарда послужила причиной того, что
использование этого маркера, как и ЛДГ,
для диагностики ИМ в настоящее время
также признано нецелесообразным..
Повышение
АСТ, превышающее повышение АЛТ, характерно
для повреждения сердечной
мышцы;
если же показатель АЛТ выше, чем АСТ, то
это, как правило, свидетельствует о
разрушении клеток печени.
Неспецифическая
реакция
на повреждение миокарда включает
нейтрофильный лейкоцитоз
(появляется через несколько часов после
окклюзии и длится 3-7 сут, число лейкоцитов
достигает 12000-15000 в мкл). СОЭ
повышается медленнее, достигает пика
в 1-ю неделю и часто остается повышенной
в течение 1-2 нед.
сБСЖК
по последовательности аминокислот
идентичен БСЖК, содержащемуся в
поперечнополосатой мышечной ткани
скелетных мышц, однако представлен в
скелетной мускулатуре в минимальном
количестве. Максимальное количество
сБСЖК находится в ткани миокарда — 0,5
мг/г. Единственная мышца, в которой
имеется относительно большое количество
сБСЖК, — это диафрагма (примерно 25% от
содержания в ткани миокарда). Некоторое
количество сБСЖК содержится в тканях
аорты, и можно предположить, что содержание
его повышается, в крови при расслаивающей
аневризме аорты. Так как сБСЖК в основном
свободно расположен в цитоплазме клеток,
в случае повреждения клеточной мембраны
кардиомиоцита он быстро попадает в
кровоток. В крови здоровых людей
циркулирует небольшое количество сБСЖК.
Соседние файлы в предмете Лабораторная диагностика
- #
- #
- #
- #
- #
- #
- #
Источник
Оглавление темы “Лабораторная диагностика инфаркта миокарда.”:
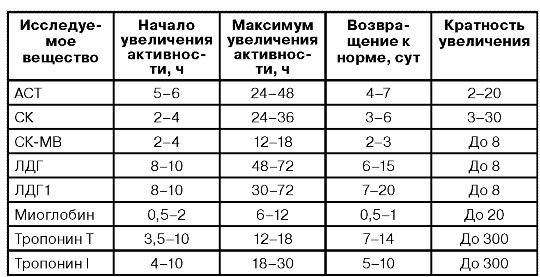
Лабораторные методы диагностики инфаркта миокарда. Ферменты инфаркта миокарда.Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ. Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза: • тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода).
• изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК); • суммарная КФК (норма – 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза. Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных. В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q.
Видео урок изменений в анализе крови при инфаркте миокардаПри проблемах с просмотром скачайте видео со страницы Здесь – Также рекомендуем “Трансаминазы при инфаркте миокарда. Лактатдегидрогеназы при инфаркте миокарда.” |
Источник
ТЕМА 13 ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА
Критерии
диагностики острого инфаркта миокарда представлены соответствующими
клиническими симптомами, характерными ЭКГ-изменениями и повышением
кардиальных протеинов в сыворотке или плазме крови.
До
недавнего времени лабораторная диагностика острого инфаркта миокарда
зависела, главным образом, от определения активности СК и СК-МВ, но
обнаружено, что при этих исследованиях часто не выявляют малые,
нетрансмуральные инфаркты (без-Q-инфаркты). Более того, диагностическая
чувствительность этих маркеров значительно ниже на ранних этапах
приступа, чем у миоглобина, тогда как диагностическая специфичность их
сопоставима. Кроме того, определение содержания миоглобина подтверждает
нормализацию кровообращения в коронарных сосудах в первые 2 ч после
начала фибринолитической терапии.
По сравнению с
измерением каталитической активности СК-МВ, иммунохимическое определение
СК-МВ (как СК-МВ концентрации, или СК-МВ-mass) обладает значительно
большей диагностической чувствительностью, особенно на ранней стадии
заболевания. В противоположность измерению иммунного ингибирования
названных маркеров определение концентрации не дает ложноположительных
высоких значений, если в сыворотке присутствуют другие изоэнзимы (СК-ВВ)
или изоформы (т.е. макро-СК). Анализ СК-МВ-активности – очень
нечувствительный метод, в диапазоне приближения к 10 Е/л. По сравнению с
анализом концентрации, детекция измеряемого нарастания СК-МВ
задерживается. Замечено, однако, что СК-МВ образуется не только в
миокарде, но и в скелетных мышцах. По этой причине данный маркер нельзя
считать параметром, специфичным для миокарда.
Измеряемыми высокоспецифичными для миокарда параметрами можно определить компоненты тропонинового комплекса. Изоформы
Тропонина
I, так же, как и тропонина Т, значительно отличаются по аминокислотной
последовательности в сердечной и скелетных мышцах. Это дает возможность
получить специфичные антитела против кардиальных изоформ тропонинов Т и I
и использовать их в тест-системах.
Таблица 13-1. Сравнение
результатов измерений cTnl и cTnT у больных с острым инфарктом миокарда
(по данным J Mair e.a. 1996, Clinica Chimica Acta v.245 pp.19-38)
Примечания. TnI – тропонин I; TnT – тропонин T; cTnI – концентрация тропонина I; cTnT – концентрация тропонина T.
Тропонин
I и Тропонин Т – компоненты сократительного аппарата, т.е. структурно
связанные белки кардиомиоцитов. Тогда как растворенные в цитозоле белки
(миоглобин) относительно быстро вымываются из зоны некроза, деструкция
сократительного аппарата более продолжительна во времени, так что
увеличение содержания тропонина определяют до 8-10 дней после острого
приступа.
Определение содержания сердечных тропонинов I
и Т дает возможность диагностики микронекроза миокарда, иногда
возникающего в случае нестабильной стенокардии. Такие повышения
концентрации тропонина имеют высокое прогностическое значение (по
отношению к инфарктам и смерти), что дает возможность оценивать степень
риска пациентов со стенокардией. Диагностическая оценка этих методов
включает серийные исследования у пациентов с острым инфарктом миокарда и
пациентов со стенокардией в сравнении с определением миоглобина,
КК-МВ-mass и других лабораторных тестов.
Таблица 13-2. Диагностическая чувствительность и специфичность лабораторных тестов при инфаркте миокарда
Таблица 13-3. Временные интервалы диагностической значимости исследования изменений маркеров ОИМ
Таблицы
показывают диагностическую чувствительность лабораторных методов при
остром инфаркте миокарда в зависимости от длительности симптомов.
Обнаружено, что диагностическая чувствительность всех параметров при ИМ
зависит от длительности болевого приступа. Если боль отмечена в течение
4-6 ч, концентрация миоглобина повышается у всех пациентов с острым
инфарктом миокарда, тогда как СК-МВ/mass увеличивется у 83%, а
содержание тропонина – у 50% больных. Общая чувствительность для трех
параметров становится 98%. Содержание миоглобина начинает увеличиваться
раньше остальных и потом возвращается к отсекающему значению на 2-й
день, тогда как СК-МВ/mass нормализуется между 3-м и 4-м днем, а
тропонин I – между 6-м и 8-м днем. Содержание тропонина I достигает
максимума на 2-й день. Это максимальное значение в 30-50 раз превышает
отсекающее. Величина отличия от отсекающего значения для тропонина I
больше, чем для миоглобина (в 8-10 раз) или СК-МВ/mass (в 14-36 раз). У
пациентов, которых лечили с применением чрескожной баллонной
ангиопластики, выявляют более выраженное увеличение всех маркеров, чем у
тех, кто получал тромболитическую терапию и консервативное лечение. У
больных со стабильной стенокардией может повышаться концентрация
миоглобина и СК-МВ/mass и отсутствовать изменение содержания сердечных
тропонинов, что служит дифференциально-диагностическим критерием.
У пациентов с
нестабильной стенокардией возможно повышение концентрации тропонина I и
СК-МВ/mass, тогда как содержание миоглобина
не
изменяется. Миоглобин, СК-МВ/mass и тропонин I показывают высокую
чувствительность (98%) в распознавании острого инфаркта миокарда, в то
же время кинетика их изменений различна. Значения содержания миоглобина
нормализуются на 2-й день после приступа, СК-МВ/mass – между 3-м и 4-м
днем, а тропонина I – между 6-м и 8-м днем. Если набор симптомов
неизвестен, то динамика этих трех параметров и согласование ее по
каждому в отдельности дает возможность дать заключение о характере
клинической картины.
Еще недавно многие медицинские
центры в практике использовали оценку динамики ферментов СК и СК-МВ с
интервалами 4-8 ч. Сейчас доступность иммунохимического определения
содержания миоглобина, СК-МВ/mass и тропонина I имеет несколько
преимуществ. Время, необходимое для анализа, коротко, созданы условия
для определения единичного образца. Более того, исследования
обеспечивают новые возможности в диагностической чувствительности и
специфичности, контроле лечения, оценке риска в развитии заболевания,
последующих особенностей нестабильной стенокардии. Имея в виду различия в
кинетике этих маркеров инфаркта миокарда, необходимо четкое
согласование времени забора крови у пациента. Стандартный подход:
• забор крови при поступлении в медицинский центр;
• через 2 ч после начала болевого симптома;
• через 4 ч;
• через 8 ч;
• затем ежедневно в течение 8 дней для контроля лечения и определения прогноза заболевания.
Одна
из наиболее важных функций врача-лаборанта – интерпретация
патологических лабораторных результатов исследований. Часто клиницисты,
назначающие серию лабораторных исследований своим пациентам,
сталкиваются с огромным, приводящим в замешательство набором цифр,
которые трудно оценить. Врач-лаборант должен не только объяснить
патологические результаты, но и подсказать, какие еще исследования
необходимо провести пациенту, чтобы подтвердить или опровергнуть диагноз
(Tanker, 1987; Statlan, 1988). Врач-лаборант должен сам выявить
патологические результаты и приложить силы и знания к их объяснению даже
без запроса о консультации. Если необходимо объяснить некоторые
патологические результаты, какие-то исследования активно повторяют или
заказывают дополнительные, чтобы оценить состояние пациента. Обычно
необходимо обращать внимание на результаты, которые не вписываются в
общую картину, не коррелируют друг с другом. В большинстве случаев эти
результаты совпадают, будучи истинно положительными (болезнь есть, и
тест ее подтверждает) или истинно
отрицательными
(болезни нет, и тест ее исключает). Однако результаты могут быть и
ложноотрицательными (болезнь есть, но тест ее исключает), и
ложноположительными (болезни нет, но тест ее подтверждает). Вероятность
положительного результата диагностического теста в присутствии болезни
называют чувствительностью метода, а вероятность отрицательного
результата в отсутствии болезни – его специфичностью.
Проанализируем,
как можно использовать эти критерии у больных с инфарктом миокарда.
Диагностическая чувствительность теста определяет вероятность
положительного результата и показывает, с какой степенью уверенности
можно ожидать положительного результата теста у больных:
•
диагностическая чувствительность (ДЧ) = количество больных с ИМ,
имеющих положительный результат теста / количество всех больных с ИМ;
•
диагностическая специфичность (ДС) = количество пациентов без
инфаркта миокарда, имеющих отрицательный результат / количество всех
протестированных пациентов без инфаркта миокарда.
Для
клинициста важнейшее значение имеет вопрос: как велика вероятность того,
что ИМ есть на самом деле, если результат теста положительный, или с
какой надежностью можно исключить поражение миокарда, если тест
отрицательный. На эти вопросы можно ответить, используя предсказательную
ценность положительного теста (ПЦП) и предсказательную ценность
отрицательного теста (ПЦО).
• ПЦП = количество
больных с ИМ с положительным результатом теста / количество больных с ИМ
с положительным результатом теста + больные без инфаркта миокарда с
ложноположительным результатом теста.
• ПЦО =
количество больных без инфаркта миокарда с отрицательным результатом
теста / количество всех отрицательных результатов (т.е. отрицательные +
ложноотрицательные).
Таблица 13-4. Диагностические критерии у больных ИМ для различных тестов
В
настоящее время многие больницы в США активно разрабатывают
нормированные пути (НП) для пациентов с различными заболеваниями.
Основная цель создания НП – уменьшение длительности пребывания пациента в
больнице и издержек, сопутствующих лечебно-диагностическому процессу.
Обычно НП в клинической практике применяют для большого объема, высокого
риска и высокой стоимости нозологий и процедур. В НП прослеживаются
следующие аспекты процесса лечения пациента: консультации и оценки,
тесты, лечение, пища, медикаменты (способ введения внутривенный и
другой), активность (действие) или безопасность, планирование разгрузки и
координация, другие дополнительные категории, основанные на
определенном диагнозе или процедуре.
В нашем
представлении НП – оптимальная последовательность действий по времени и
выбор времени вмешательств всех участников технологического процесса
производства результатов исследований с целью снижения задержки и
расхода ресурсов и максимального повышения качества результатов
лабораторных исследований. Другими словами, НП – способ визуализации
всех частей единого технологического процесса производства анализов (от
назначения исследований клиницистом, подготовки пациента до получения
результатов и использования их в диагностике и лечении). Таким образом,
если предложенная индустриальная модель технологического процесса
производства результатов лабораторных исследований определяет, что и как
необходимо делать, то НП показывают, когда необходимо вмешаться в
технологический процесс, и на каком этапе, чтобы снизить количество
ошибок, расход ресурсов (моноветы, реактивы, калибраторы и т.д.) и чтобы
результаты исследований максимально соответствовали реальным. Мы
приводим нормированный путь проведения биохимических исследований для
пациента с подозрением на инфаркт миокарда (ИМ). Следует подчеркнуть,
что НП для экстренных исследований значительно отличается от НП для
плановых исследований. Общее требование для экстренных исследований –
выполнение их в течение 45-60 мин после доставки материала в
лабораторию, а на исследование жизненно важных параметров (например,
содержание гемоглобина, гематокрит, КЩС, концентрация калия и глюкозы)
отводят 3-5 мин.
Схема показывает,
как «работает» НП диагностики ИМ. После назначения исследований АСТ,
АЛТ, КК, КК-МВ, тропонина Т задействуют критерии (пороги) этого этапа.
•
Первый порог. Когда можно назначать эти исследования? – Такие
исследования для экстренной диагностики могут быть выполнены в любое
время, поэтому их не включают в последующий анализ;
•
Второй порог. Сколько времени прошло после острого ангинозного приступа?
– В нашем примере прошло 6 ч, значит, пороги не задействуют, а если бы
после острого приступа прошло 5 сут, порог бы включился, так как в этот
период ИМ определение миоглобина для диагностики заболевания не
используются.
На этапе технологической операции взятия
крови на исследования, несмотря на неподготовленность пациента к
исследованиям, порог не включается, так как неотложные исследования
проводят без подготовки, а если бы пациенту были назначены плановые
биохимические исследования, то этот порог включился бы и потребовал
вмешательства специалистов лаборатории для устранения отклонений от НП.
Кровь на исследования у пациента с подозрением на ИМ необходимо взять в
течение 10 мин после получения процедурной сестрой заявки и в течение
такого же времени доставить в лабораторию. Отклонения по времени на этих
этапах также анализируют и по ним вырабатывают программы устранения
причин, приводящих к нарушениям. Аналогичным образом работают критерии
порогов для технологических операций взятия, приема и обработки крови.
В
случае получения результатов исследований, требующих немедленных
действий со стороны клинициста, врач-лаборант срочно информирует его об
этом. По этой причине в нашем случае при получении повышенных значений
КК, КК-МВ, миоглобина врач-лаборант сообщает клиницисту о результатах
(критерий не включается) и только затем приступает к написанию
заключения.
На этапе
технологической операции передачи результатов исследований врач-лаборант
обязан указать время поступления материала в лабораторию и время выдачи
ответа, а также убедиться в том, что клиницист получил результаты.
Выполнение этих порогов имеет большое значение, особенно при проведении
экстренных исследований и исследований по жизненным показаниям, так как
устраняет повод для разбирательства в случаях, если лаборатория
сталкивается с низкой ответственностью клинициста, который в качестве
своего оправдания бездействия ссылается на то, что он не был вовремя
информирован о результатах исследований.
На этапе
передачи результатов исследований НП не заканчивается, так как он должен
обязательно включать постаналитическую часть единого технологического
процесса производства анализов. Эта часть техно – логического процесса
не менее важна, чем предыдущие, так как она позволяет оценить все
предыдущие этапы. Администратором на этом этапе НП становится клиницист,
он отвечает за интерпретацию и использование полученной лабораторной
информации. Критерии НП на постаналитической части:
• соответствуют ли результаты исследований объективному состоянию пациента;
• отражены ли результаты исследований в истории болезни;
• какие действия предприняты клиницистом по результатам исследований;
• повлияли ли результаты исследований на качество оказания медицинской помощи пациенту.
Если
результаты исследований не востребованы клиницистом, это становится
критерием срабатывания порогов и служит материалом для анализа и
выяснения причины, почему это происходит. Врач-лаборант не должен
устраняться от анализа причин срабатывания порогов на постаналитической
части технологического процесса, так как в противном случае это приведет
к нарушению взаимодействия всех участников НП. Кроме того, НП
становится законченным только в этом частном случае, а при проведении
лечения пациента он повторится через какое-то время (исследования будут
назначены повторно для оценки проводимого лечения, определения прогноза
или диагностики возникших осложнений), и оценивать его придется уже в
динамике, с учетом выявленных отклонений в предыдущем случае.
Источник