Активация раас при сердечной недостаточности
При ослаблении сократительной функции сердечной мышцы и появлении застойных явлений в организме больного норадреналин, высвобождающийся из окончаний симпатических нервов, возбуждая b1-адренорецепторы клеток юкстагломерулярного аппарата, стимулирует секрецию ренина. Другим стимулом секреции ренина является снижение почечного кровотока в результате вызванной катехоламинами (через а-адренорецепторы) констрикции эфферентных артериол почечных клубочков.
Позже усугубить эти механизмы может диуретическая терапия, которая способствует увеличению транспорта натрия хлорида через стенку почечных канальцев.
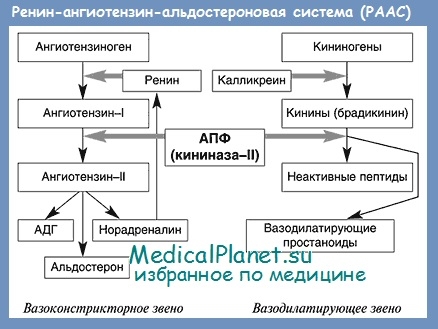
Известно, что ренин-ангиотензин-альдостероновая система (РААС) играет важную роль в регуляции артериального давления и водно-электролитного обмена. В последние годы получены убедительные доказательства того, что чрезмерная активация РААС, которая обнаруживается у большинства больных ХСН, является независимым от других факторов показателем неблагоприятного прогноза.
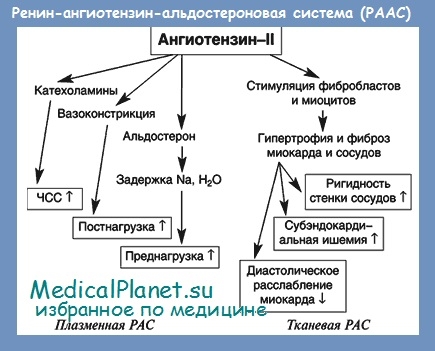
Ангиотензин II играет центральную роль в РААС. В частности, он является мощным вазоконстриктором, несколькими путями повышает артериальное давление, вызывает тахикардию, приводит к ремоделированию миокарда. Ангиотензин II способствует задержке в организме натрия и воды. Эти действия прямо или косвенно опосредуются через симпатическую нервную систему, антидиуретический гормон, альдостерон или угнетение активности блуждающего нерва.
Ангиотензин II оказывает существенное влияние на миокардиоциты и участвует в ремоделировании миокарда как после инфаркта, так и при других заболеваниях. Ремоделирование миокарда, развивающееся в этих случаях, является непременным фактором, определяющим течение и исходы ХСН.
Роль ангиотензина II в развитии ХСН существенно повышается при наличии у больных атеросклеротических изменений в коронарных артериях. В таких случаях ангиотензин II способствует усиленному окислению ЛПНП, ускоренному прогрессированию атеросклероза, появлению нестабильных атеросклеротических бляшек. Известно, что ангиотензин II образуется непосредственно в тканях, в том числе в сердце и сосудах, где, как и во многих других органах, имеется собственная ангиотензиновая система.
В пораженных атеросклерозом артериях эта система особенно активна (Н.А. Грацианский).

Ангиотензин II способствует также образованию супероксида кислорода, который приводит к разрушению важнейшего вазодилатирующего фактора – NО (окиси азота). Вследствие этого снижается вазодилатирующая функция сосудистого эндотелия, возникают ишемические изменения в миокарде, снижается его сократительная функция.
Совокупность этих изменений может быть причиной разрушения или разрыва атеросклеротических бляшек, возникновения вазоспастических явлений в сердце, что может вызывать обострение ИБС, появление нестабильных форм стенокардии и инфаркта миокарда, внезапную коронарную смерть, развитие острой и хронической сердечной недостаточности.
Ангиотензин II считается главным эффекторным пептидом РААС. Почти все известные эффекты активации РААС в крови, органах и тканях обусловлены влиянием ангиотензина П на его специфические рецепторы.
Большое практическое значение имеет то, что образование главного эффекторного пептида РААС – ангиотензина II – может происходить без участия как ангиотензин I-превращающего фермента, так и ренина.
Подавляя активность АПФ с помощью ингибитора АПФ, можно снизить уровень ангиотензина II и тем самым повлиять на механизмы обратной связи. Благодаря этому ингибиторы АПФ способны оказывать положительное влияние на течение сердечной недостаточности.
Компенсаторный характер нейрогуморальных изменений, повышение активности симпатической и ангиотензин-альдостероновой систем на раннем этапе застойной сердечной недостаточности заключаются в том, что возникают вазоконстрикция, компенсаторная тахикардия, гипертрофия миокарда и умеренная (по старой терминологии – тоногенная) дилатация сердца.
Адаптивный характер этих изменений проявляется, в частности, в том, что активизация РААС при начинающейся сердечно-сосудистой недостаточности способствует поддержанию артериального давления на уровне, обеспечивающем достаточный кровоток и перфузию кислорода в жизненно важных органах. Однако по мере прогрессирования заболевания компенсаторные реакции постепенно дают противоположные результаты. Длительная активация РААС приводит к прогрессированию заболевания и ухудшению прогноза.
Гиперактивация симпатического отдела нервной системы сопровождается повышением в плазме крови уровня норадреналина, что также обусловливает вазоконстрикцию, усиление тахикардии, задержку в организме натрия и воды. Нарастание симпатической активности может в определенной мере ослабляться вследствие того, что активность адренергических рецепторов саморегулируется по механизму отрицательной обратной связи. При этом, однако, может нарушаться функция барорецепторов, что вызывает дальнейшее повышение активности САС.
Повышенный уровень норадреналина в плазме крови является следствием увеличения его секреции с одновременным снижением клиренса. Норадреналин плазмы крови экскретируется в основном почками. При сердечной недостаточности в результате снижения клубочковой фильтрации клиренс норадреналина снижается и соответственно увеличивается его уровень в плазме. Ингибиторы АПФ могут снижать содержание норадреналина в плазме крови и нормализовать опосредованные САС рефлексы. Возможно, это происходит благодаря саморегуляции активности адренергических рецепторов.
Многими исследователями показана бесспорная связь между высоким уровнем циркулирующего норадреналина и повышенной летальностью больных с хронической застойной сердечной недостаточностью. Отрицательное воздействие избытка катехоламинов на сердце обусловлено многими факторами: прямым кардиотоксическим эффектом, непрямым влиянием за счет активации нейрогуморальных механизмов и повышения общего периферического сопротивления, активизацией свертывающей системы крови, нарушением функции бета-адренорецепторов, частыми нарушениями сердечного ритма и т.д.
Чрезмерная симпатическая активность вызывает повреждение миокардиоцитов вплоть до их некроза.
При сердечной недостаточности возрастает активность барорецепторов, что ведет к повышению симпатической стимуляции сердца и периферических сосудов. Ангиотензин II может вызывать еще большее повышение симпатической активности.
Определенное значение в патогенезе сердечной недостаточности имеет изменение концентрации в крови предсердного натрийуретического фактора. Известно, что этот фактор секретируется миокардом предсердий и желудочков. Повышение напряжения стенок предсердий или желудочков, обычно связанное с ростом давления наполнения соответствующих камер сердца, является основным стимулом для увеличенной секреции предсердного натрийуретического фактора.
Предсердный натрийуретический фактор способствует дилатации артерий, он снижает вазоконстрикторный эффект, обусловленный другими нейрогормонами, стимулирует экскрецию натрия и воды из организма. При сердечной недостаточности выраженность этого вазодилататорного эффекта снижается из-за вазоконстрикторных эффектов других гормонов и потенциально положительное влияние предсердного натрийуретического фактора на функцию почек ослабевает.
Еще одно из звеньев патогенеза сердечной недостаточности связано с изменением содержания в крови антидиуретического гормона. Повышенная активность симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем стимулирует секрецию антидиуретического гормона клетками задней доли гипофиза. Повышение уровня ангиотензина II также может стать важным стимулом увеличения секреции антидиуретического гормона.
Антидиуретический гормон резко уменьшает экскрецию воды почками, увеличивает ее реабсорбцию в дистальных канальцах и собирательных трубочках, значительно усиливает задержку воды в организме. Кроме того, он может вызвать распространенную вазоконстрикцию. На фоне высокой концентрации в крови больных с застойной сердечной недостаточностью антидиуретического гормона резко снижается экскреция натрия и выводы почками, нарастают отеки, увеличивается жажда (часто становится нестерпимой). Очень высокое содержание антидиуретического гормона часто выявляется у больных с сердечной недостаточностью, которые длительно лечатся большими дозами диуретиков-салуретиков.
Следует учитывать, что с помощью ингибиторов АПФ можно существенно снизить уровень антидиуретического гормона.
– Вернуться в раздел нашего сайта “кардиология”
Оглавление темы “Болезни сердца и перикарда”:
- Эксудативный перикардит – клиника, диагностика
- Адгезивный перикардит – клиника, диагностика
- Бактериальные и вирусные перикардиты – клиника, диагностика
- Ревматические, уремические, посттравматические перикардиты – клиника, диагностика
- Гидроперикард и перикардиальные кисты – клиника, диагностика
- Опухоли сердца – клиника, диагностика
- Лечение перикардита – пункция перикарда
- Сердечная недостаточность – определение, эпидемиология
- Причины и механизмы развития сердечной недостаточности
- Ренин-ангиотензин-альдостероновая система (РААС) при сердечной недостаточности
Источник
Система ренин-ангиотензин-альдостерон
Ренин-ангиотензиновая система (РАС) или ренин-ангиотензин-альдостероновая система (РААС) — это гормональная система человека и млекопитающих, которая регулирует кровяное давление и объём крови в организме.
Компоненты системы[править | править код]
- Ангиотензиноген
- Ангиотензин I
- Ангиотензин II
- Проренин
- Ренин
- Ангиотензинпревращающий фермент
- Альдостерон
Компоненты ренин-ангиотензиновой системы[править | править код]
Ренин-ангиотензин альдестероновый каскад начинается с биосинтеза препроренина на матрице рениновой мРНК в юкстагломерулярных клетках и превращается в проренин путём отщепления 23 аминокислот. В эндоплазматическом ретикулуме проренин подвергается гликозилированию и приобретает 3-D структуру, которая характерна для аспартатных протеаз. Готовая форма проренина состоит из последовательности включающей 43 остатка присоединённых к N-концу ренина, содержащего 339-341 остаток. Предполагается, что дополнительная последовательность проренина (prosegment) связана с ренином для предотвращения взаимодействия с ангиотензиногеном. Большая часть проренина свободно выбрасывается в системный кровоток путём экзоцитоза, но некоторая доля превращается в ренин путём действия эндопептидаз в секреторных гранулах юкстагломерулярных клеток. Ренин, образуемый в секреторных гранулах в дальнейшем выделяется в кровоток, но этот процесс жёстко контролируется давлением, ангиотензином 2, NaCl, через внутриклеточные концентрации ионов кальция. Поэтому у здоровых людей объём циркулирующего проренина в десять раз выше концентрации активного ренина в плазме . Однако, все же остаётся не понятным, почему концентрация неактивного предшественника настолько высока.
Контроль секреции ренина[править | править код]
Активная секреция ренина регулируется четырьмя независимыми факторами:
- Почечным барорецепторным механизмом в афферентной артериоле, который улавливает изменение почечного перфузионного давления.
- Изменениями уровня NaCl в дистальном отделе нефрона. Этот поток измеряется как изменение концентрации Cl- клетками плотного пятна дистального извитого канальца нефрона в области, прилегающей к почечному тельцу.
- Стимуляцией симпатическими нервами через бета-1 адренергические рецепторы.
- Механизмом отрицательной обратной связи, реализованным через прямое действие ангиотензина 2 на юкстагломерулярные клетки.
Секрецию ренина активирует снижение перфузионного давления или уровня NaCl и повышение симпатической активности. Ренин также синтезируется и в других тканях, включая мозг, надпочечник, яичники, жировая ткань, сердце и сосудах.
Контроль секреции ренина — определяющий фактор активности РААС.
Механизм действия ренин-ангиотензиновой системы[править | править код]
Ренин регулирует начальный, ограничивающий скорость, этап РААС путём отщепления N-концевого сегмента ангиотензиногена для формирования биологически инертного декапептида ангиотензина 1 или Ang-(1-10). Первичный источник ангиотензиногена — печень. Долговременный подъём уровня ангиотензиногена в крови, который происходит во время беременности, при синдроме Иценко-Кушинга или при лечении глюкокортикоидами, может вызвать гипертензию, хотя и существуют данные о том, что хроническое повышение концентрации ангиотензина в плазме частично компенсируется снижением секреции ренина.
Неактивный декапептид Ang 1 гидролизуется в клетках эндотелия лёгочных капилляров ангиотензинпревращающим ферментом (АПФ), который отщепляет С-концевой дипептид и, таким образом, формируется октапептид Ang 2 [Ang-(1-8)], биологически активный, мощный вазоконстриктор. АПФ представляет собой экзопептидазу и секретируется главным образом лёгочным и почечным эндотелием, нейроэпителиальными клетками.
Ферментативная активность АПФ заключается в повышении вазоконстрикции и снижении вазодилятации.
Новые данные о компонентах ренин-ангиотензиновой системы[править | править код]
Хотя Ang2 наиболее биологически активный продукт РААС, существуют данные, что другие метаболиты агиотензинов 1 и 2 могу также могут иметь значительную активность. Ангиотензин 3 и 4 (Ang 3 & Ang 4) формируются путём отщепления аминокислот с N-конца от Ангиотензина 2 вследствие действия аминопептидаз А и N. Ang 3 и 4 наиболее часто вырабатываются в тканях с высоким содержанием этих ферментов, например, в мозге и почках. Ang 3 [Ang-(2-8)], гептапептид образующий в результате отщепления аминокислоты с N-конца, наиболее часто он встречается в центральной нервной системе, где Ang III играет важную роль в поддержании кров давления. Ang IV [Ang-(3-8)] гексапептид является результатом дальнейшего ферментативного расщепления AngIII. Предполагается, что Ang 2 и 4 работают кооперативно. В качестве примера можно привести повышение кровяного давления в мозгу, вызываемое действием этих ангиотензинов на AT1-рецептор. Причём этот гемодинамический эффект Ang 4 требует наличия как Ang2 так и самого AT1- рецептора.
Пептиды, получаемые отщеплением аминокислот с С-конца, могут также иметь биологическую активность. Например, Ang-(1-7), гептапептидный фрагмент ангиотензина 2, может образовываться как из Ang2 так и из Ang1 действием ряда эндопептидаз или действием карбоксипептидаз (например, гомологом АПФ, названным АПФ2) конкретно на Ang2. В отличие от АПФ, АПФ2 не может участвовать в реакции превращения Ang1 в Ang2 и его активность не подавляется ингибиторами ACE (ACEIs). Ang-(1-7) реализующий свои функции через определённые рецепторы, впервые был описан как вазодилататор и как натуральный ингибитор ACEI. Ему также приписываются и кардиопротекторные свойства. АПФ2 может также отщеплять одну аминокислоту с С-конца, результатом такого действия является Ang-(1-9), пептид с неизвестными функциями.
Рецепторы ангиотензина II[править | править код]
Описаны как минимум 4 подтипа рецепторов к ангиотензину.
- Первый тип AT1-R участвует в реализации наибольшего числа установленных физиологических и патофизиологических функций ангиотензина 2. Действие на сердечно-сосудистую систему (вазоконстрикция, повышение давления крови, повышение сократимости сердца, сосудистая и сердечная гипертония), действие на почки (реабсорбция Na+, ингибирование выделения ренина), симпатическую нервную систему, надпочечника (стимуляция синтеза альдостерона). AT1-R рецетор также является посредником во влиянии ангиотензина на клеточный рост, пролиферацию, воспалительные реакции, и оксидативный стресс. Этот рецептор связан с G-белком и содержит семь встроенных в мембрану последовательностей. AT1-R широко представлен во многих типах клеток, являющихся мишенью Ang 2.
- Второй тип AT2-R широко представлен в период эмбрионального развития мозга, почек затем же в период постнатального развития количество этого рецептора падает. Имеются данные, что, несмотря на низкий уровень экспрессии во взрослом организме, AT2 рецептор может выступать в качестве посредника в процессе вазодилятации и также оказывать антипролиферативный и антиапоптотичекие эффекты в гладких мышцах сосудов и угнетать рост кардиомиоцитов. В почках, как предполагается, активация AT2 влияет на реабсорбцию в проксимальных извитых канальцах и стимулировать реакции превращения простагландина E2 в простагландин F2α.2,7. Однако, важность некоторых из этих At2 связанных действий остаётся неизученной.
- Функции третьего типа (AT3) рецепторов не до конца изучены.
- Четвёртый тип рецепторов (AT4) участвует в выделении ингибитора активатора плазминогена (под действием ангиотензина 2, а также 3 и 4). Предполагается, что эффекты характерные для Ang 1-7, включая вазодилятацию, натрийурез, снижение пролиферации, и защита сердца, реализуются через уникальные рецепторы, которые не связываются с Ang 2, такими как MAS рецепторы.
Также нужно отметить, что последние данные указывают на существование высокоаффинных поверхностных рецепторов, которые связывают как ренин, так и проренин. Они находятся в тканях мозга, сердца, плаценты и почек (в поэндотелиальной гладкой мускулатуре и мезангие). Эффекты таких рецепторов направлены на локальное увеличение выработки Ang2 и запуска внеклеточных киназ, таких как, MAP -киназ, к которым относится ERK1 и ERK2. Эти данные пролили свет на Ang2-независимые механизмы клеточного роста, активируемые ренином и проренином.
Влияние на прочие секреции[править | править код]
Как отмечалось ранее Ang2, через AT1 рецепторы стимулирует выработку альдостерона клубочковой зоной надпочечника . Альдостерон наиболее важный регулятор K+- Na+ баланса и таким образом играет важную роль в контроле объёма жидкостей. Он увеличивает реабсорцию натрия и воды в дистальных извитых канальцах и собирательных трубочках (а также в толстой кишке и слюнных и потовых железах) и таким образом вызывает экскрецию ионов калия и водорода. Ангиотензин 2 вместе с внеклеточным уровнем ионов калия – наиболее значимые регуляторы альдостерона, но синтез Ang2 также может быть вызван АКТГ, норадреналином, эндотелином, серотонином, а ингибирован АНП и NO. Также важно отметить, что Ang 2 важный фактор трофики клубочковой зоны надпочечников, которая без его наличия может атрофироваться.
См. также[править | править код]
- Гормоны
- Эндокринная система
- Рениновый рецептор
Ссылки[править | править код]
- Medicus Amicus: Средства, действующих на ренин-ангиотензиновую систему
- ЭНДОТЕЛИЙ СОСУДОВ — ОСНОВНОЙ РЕГУЛЯТОР МЕСТНОГО КРОВОТОКА
C09
Источник
